题目内容
6.守恒思想是以定量的角度观察化学世界的永恒主题.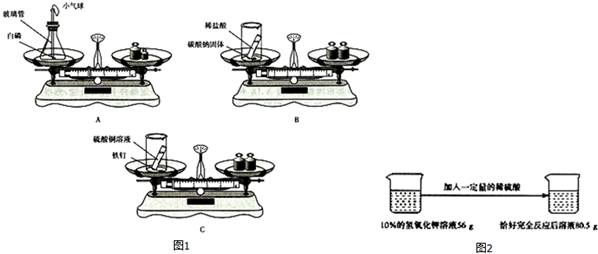
(1)用如图1所示的3个实验验证质量守恒定律,其中实验后天平不能保持平衡的是B(填序号),理由是装置未密闭,生成的二氧化碳气体逸出,导致左盘中容器内的物质总质量减少.
(2)卫星运载火箭的动力由高氯酸铵(NH4ClO4)发生反应提供,化学方程式为:
2NH4ClO4$\frac{\underline{\;高温\;}}{\;}$N2↑+C12↑+202↑+4X.则
①X的化学式为H2O.
②该反应属于基本反应类型中的分解反应.
(3)从微观角度分析有助于我们理解质量守恒定律.在一密闭容器内有四种物质A、B、C、D,它们在一定条件下发生化学反应.经过一段时间后停止反应,其中A、B、C、D的微观示意图和反应前后各物质的质量如下表所示.
| 物质 | A | B | C | D |  氮原子 氮原子 氧原子 氧原子 氢原子 氢原子 |
| 微观示意图 |  |  |  | 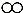 | |
| 反应前质量/g | 100 | 20 | X | y | |
| 反应后质量/g | 32 | 140 | 126 | 46 |
②该反应中B和C的质量比为10:9.
③表中x的值是18.
(4)将0.8g草酸亚铁(FeC204)放在一个可称量的敞口容器中加热灼烧,固体质量随温度升高而变化的数据如下(下表中所注明的各温度下,容器中的固体均为纯净物):
| 温度(℃) | 25 | 350 | 400 | 500 | 600 | 900 |
| 固体质量(g) | 0.80 | 0.80 | 0.40 | 0.44 | 0.44 | 0.43 |
②400℃~500℃,发生了化合反应(填“分解反应”或“化合反应”).
③600℃~900℃,发生的反应可表示为6Fe2O3$\frac{\underline{\;高温\;}}{\;}$4Fe3O4+O2↑.
(5)根据图2的信息计算:
①加人的稀硫酸质量为24.5g.
②所用稀硫酸溶质的质量分数为20%.(化学方程式:2K0H+H2S04=K2S04+2H20)
分析 (1)根据三个实验中所发生的反应的来完成解答:
(2)根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变进行分析;
(3)①根据化学反应的实质进行分析;
②根据反应前后原子的种类不变来书写出该反应的化学方程式,然后计算出反应中B、C的质量比值即可;
③根据Ⅲ中计算的质量比结合B的质量变化进行解答即可;
(4)根据题干提供的信息进行分析,温度达到400℃时物质的质量是0.40g,说明物质的质量减小,发生的是分解反应;当温度达到500℃时,质量达到0.44g,说明发生了化合反应;达到900℃时,物质的质量开始减小,发生的是分解反应进行分析;
(5)①根据质量守恒定律计算加入的硫酸质量;
②根据硫酸和氢氧化钾反应生成氯酸钾和水,计算硫酸的质量分数.
解答 解:(1)分析三个实验可以知道,反应A中是在密闭的容器中反应,B是在敞口的容器中反应且生成了气体,而C虽然是敞口的容器中反应但是没有生成气体,所以可以判断反应前后B实验实验前后天平不能保持平衡;
(2)①通过方程式可知反应物中含有:2个N原子、8个H原子、2个Cl原子、8个O原子;生成物中已经有了2个N原子、2个Cl原子、4个O原子,还缺少8个H原子、4个O原子,又因为X前面个数为4,所以化学式中需要有2个H原子、1个O原子,所以化学式为H2O;
②该反应满足分解反应一变多的条件,所以属于基本反应类型中的分解反应;
(3)①根据化学反应的实质可以知道,在反应的过程中是分子裂解成原子,原子进行了重新组合而得到新的分子,所以该过程中原子的种类、原子的数目和原子的质量都没有发生改变,所以化学反应前后质量守恒;
②根据表格中的信息可以知道,反应前后B的质量增加了,所以B为生成物,而反应前后A物质的质量减少了,所以A为反应物,结合反应前后元素的种类不变可以知道,反应物为A和D,而生成物为B和C,其中A为NH3,B为NO,C为H2O,D为O2,所以可以写出该反应的化学方程式为:4NH3+5O2$\frac{\underline{\;一定条件\;}}{\;}$4NO+6H2O;
反应中物质的质量比等于它们的相对分子质量乘以化学计量数的比,所以可以知道B和C的质量比为:120:108=10:9;
③根据Ⅲ的解答可以知道,反应中生成B的质量为:140g-20g=120g,而B:C=10:9,所以可以判断反应中生成C的质量为108g,即126-x=108,所以x=18.
(4)①400℃时,容器中的固体若为碳酸盐,则草酸亚铁分解生成的是碳酸亚铁和一氧化碳,
FeC2O4$\frac{\underline{\;\;△\;\;}}{\;}$FeCO3+CO
144 116
若只含有碳酸亚铁,质量不会减小一半,所以根据铁元素守恒,FeC2O4分解时,先转变为FeO和二氧化碳和一氧化碳,容器中的固体为FeO;
②当温度达到500℃时,质量达到0.44g,说明发生了化合反应;
③达到900℃时,物质的质量开始减小,发生的反应可表示为:6Fe2O3$\frac{\underline{\;高温\;}}{\;}$4Fe3O4+O2↑;
(5)①依据质量守恒定律可知,加入的稀硫酸质量为:80.5g-56g=24.5g;
②设硫酸的质量分数为x,
2K0H+H2S04=K2S04+2H20
112 98
10%×56g x×24.5g
$\frac{112}{10%×56g}$=$\frac{98}{x×24.5g}$
x=0.2=20%
故答案为:(1)B;装置未密闭,生成的二氧化碳气体逸出,导致左盘中容器内的物质总质量减少;
(2)①H2O;
②分解;
(3)①化学反应前后原子的种类不变,原子的数目不变,原子的质量不变;
②10:9;
③18;
(4)①FeO;
②化合反应;
③6Fe2O3$\frac{\underline{\;高温\;}}{\;}$4Fe3O4+O2↑;
(5)①24.5g;
②20%.
点评 要想解答好这类题目,首先,要理解和熟记微粒观点及模型图的应用,以及与之相关的知识.然后,根据所给的问题情景或图表信息等,结合所学的相关知识和技能,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.

| A. | 铁在氧气中燃烧 | B. | 过氧化氢与二氧化锰制氧气 | ||
| C. | 水的电解 | D. | 石蜡在氧气中燃烧 |
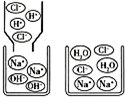
| A. | 稀盐酸中存在的粒子是H+、Cl-和H20 | |
| B. | 反应结束时溶液的pH=7 | |
| C. | 该反应的实质是H+和OH-结合生成H20分子 | |
| D. | 若两者恰好完全反应,所得溶液中溶质的质量分数为35.1%,则此溶液中钠离子与水分子的个数比为351:649 |
| A. | 氧气的密度比空气略大----用于急救病人 | |
| B. | 稀有气体的性质稳定----作保护气 | |
| C. | 煤气能燃烧---用于煮熟食物 | |
| D. | 干冰升华吸热----用于人工降雨 |
 归纳法是学习化学的重要方法,以下关系图是物质与分子、原子的关系图.
归纳法是学习化学的重要方法,以下关系图是物质与分子、原子的关系图.