12.漂白粉的主要成分为次氯酸钙[Ca(ClO)2]和氯化钙,既可用作漂白剂,又可用作消毒剂.漂白粉中有效成分是[Ca(ClO)2],漂白的原理是:Ca(ClO)2在空气中发生反应Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;HClO是一种酸性比盐酸弱的酸,不稳定,具有漂白性,能使品红等有色物质褪色.
(1)漂白粉是一种混合物(填“纯净物”或“混合物”).
(2)HClO在常温下分解,反应为2HClO=2HCl+O2↑.某瓶HClO溶液放置一段时间后,溶液的pH减小(填“增大”或“减小”或“不变”).
(3)有一包长时间放置的漂白粉,想知道该漂白粉是否变质,某同学设计了下列探究实验.
【提出问题】长时间放置的漂白粉是否变质?
【猜想】
猜想1:该漂白粉未变质,固体成分为CaCl2、Ca(ClO)2;
猜想2:该漂白粉部分变质,固体成分为CaCl2、Ca(ClO)2、CaCO3;
猜想3:该漂白粉全部变质,固体成分为CaCl2、CaCO3.
【实验探究】限选试剂及仪器:盐酸、石灰水、品红溶液、试管、带导管的单孔塞.
(1)漂白粉是一种混合物(填“纯净物”或“混合物”).
(2)HClO在常温下分解,反应为2HClO=2HCl+O2↑.某瓶HClO溶液放置一段时间后,溶液的pH减小(填“增大”或“减小”或“不变”).
(3)有一包长时间放置的漂白粉,想知道该漂白粉是否变质,某同学设计了下列探究实验.
【提出问题】长时间放置的漂白粉是否变质?
【猜想】
猜想1:该漂白粉未变质,固体成分为CaCl2、Ca(ClO)2;
猜想2:该漂白粉部分变质,固体成分为CaCl2、Ca(ClO)2、CaCO3;
猜想3:该漂白粉全部变质,固体成分为CaCl2、CaCO3.
【实验探究】限选试剂及仪器:盐酸、石灰水、品红溶液、试管、带导管的单孔塞.
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品于试管中,加入适量的稀盐酸,塞上带导管的单孔塞,把导管插入另一试管里的石灰水中. | 有气体产生,气体使石灰水变浑浊. | 猜想2成立 |
| ②在上述反应后的试管中加少量品红溶液. | 品红溶液褪色 |
8.配制一定质量分数的稀硫酸不需要用到的仪器是( )
| A. | 玻璃棒 | B. | 烧杯 | C. | 天平 | D. | 量筒 |
4.某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格).
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演】(1)该反应的化学方程式H2SO4+2NaOH═Na2SO4 +2H2O.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】(2)针对疑问,太家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是猜想四.
【实验探究】(3)①丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
②为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaC12溶液、Na2CO3溶液,进行如下三个方案的探究.
【得出结论】通过探究,全班同学一致确定猜想二是正确的.
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出【实验探究】②中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:①实验操作中的错误是将pH试纸直接放入待测液测pH.②实验方案中也有一个是错误的,错误的原因是生成的Na2SO4也会与BaCl2反应产生白色沉淀,不一定是有过量H2SO4引起的.
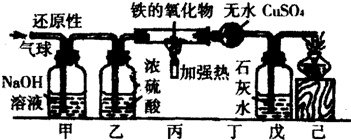
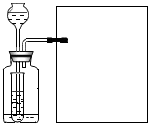
【剖析本质】实验后,老师又带领大家从微观的角度来理解此反应的实质,请你和同学们一起在如图1反应后的方框中补画未画全的微粒.
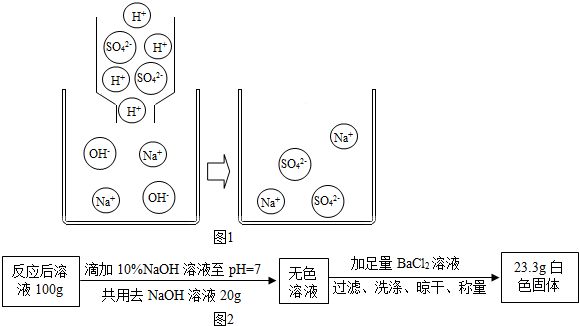
【定量探究】
取上述【演示实验】反应后烧杯中的溶液100g,设计如图2实验:
试计算上述【演示实验】反应后溶液中Na2SO4的质量分数是多少?(列出计算过程)
0 166792 166800 166806 166810 166816 166818 166822 166828 166830 166836 166842 166846 166848 166852 166858 166860 166866 166870 166872 166876 166878 166882 166884 166886 166887 166888 166890 166891 166892 166894 166896 166900 166902 166906 166908 166912 166918 166920 166926 166930 166932 166936 166942 166948 166950 166956 166960 166962 166968 166972 166978 166986 211419
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演】(1)该反应的化学方程式H2SO4+2NaOH═Na2SO4 +2H2O.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】(2)针对疑问,太家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是猜想四.
【实验探究】(3)①丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
②为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaC12溶液、Na2CO3溶液,进行如下三个方案的探究.
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaC12溶液 |
| 实验操作 |  | 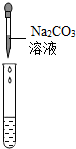 | 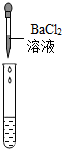 |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 有产生气泡 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出【实验探究】②中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:①实验操作中的错误是将pH试纸直接放入待测液测pH.②实验方案中也有一个是错误的,错误的原因是生成的Na2SO4也会与BaCl2反应产生白色沉淀,不一定是有过量H2SO4引起的.
【剖析本质】实验后,老师又带领大家从微观的角度来理解此反应的实质,请你和同学们一起在如图1反应后的方框中补画未画全的微粒.

【定量探究】
取上述【演示实验】反应后烧杯中的溶液100g,设计如图2实验:
试计算上述【演示实验】反应后溶液中Na2SO4的质量分数是多少?(列出计算过程)
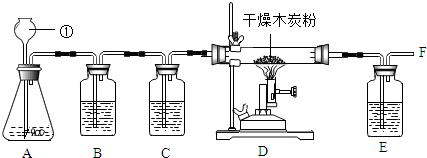
 实验室常用硫化亚铁(FeS)与稀H2SO4发生复分解反应制取硫化氢气体.硫化氢气体是一种无色有臭鸡蛋气味的有毒气体,它能溶于水,密度比空气大,其水溶液叫氢硫酸.某学生要在实验室中制取硫化氢气体,多余的硫化氢气体要进行处理.
实验室常用硫化亚铁(FeS)与稀H2SO4发生复分解反应制取硫化氢气体.硫化氢气体是一种无色有臭鸡蛋气味的有毒气体,它能溶于水,密度比空气大,其水溶液叫氢硫酸.某学生要在实验室中制取硫化氢气体,多余的硫化氢气体要进行处理.