5.下列图象能正确反映对应变化关系的是( )
| A. |  向一定量的MnO2中加入H2O2溶液 | B. |  向石灰石中加入稀盐酸 | ||
| C. |  红磷在盛有空气的密闭容器中燃烧 | D. |  加热一定量的高锰酸钾固体 |
4.为了测定某粉末状黄铜(铜、锌合金)样品中铜的质量分数,小军取一定质量的黄铜样品放入烧杯中,再取40g稀盐酸分4次加入烧杯中,均充分反应,实验数据如下:
(1)反应结束后,共生成氢气0.6g;
(2)所用稀盐酸中溶质的质量分数为7.3%;
(3)用36.5%的浓盐酸配制40g上述稀盐酸,需要浓盐酸的质量为8g;
(4)黄铜样品中铜的质量分数为多少?
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 加入稀盐酸质量(g) | 10 | 10 | 10 | 10 |
| 剩余固体的质量(g) | 9.10 | 8.45 | 7.80 | 7.80 |
(2)所用稀盐酸中溶质的质量分数为7.3%;
(3)用36.5%的浓盐酸配制40g上述稀盐酸,需要浓盐酸的质量为8g;
(4)黄铜样品中铜的质量分数为多少?
3.有一包白色粉末,可能含有氯化钡、氢氧化钠、碳酸氢铵、氯化钠、无水硫酸铜、碳酸钙中的一种或几种.为确定其组成.进行如下实验:
①取少量该粉末置于烧杯中,未嗅到任何气味;向烧杯中加人适量的水,充分搅拌,静置后,观察到上层溶液呈无色,烧杯底部有蓝白色固体;过滤.
②向上述滤液中滴加几滴硝酸银溶液,溶液变浑浊.
③将上述滤渣投入盛有足量稀盐酸的烧杯中,充分搅拌,有无色无味的气体产生.烧杯底部有白色固体剩余.
则下列说法正确的是( )
①取少量该粉末置于烧杯中,未嗅到任何气味;向烧杯中加人适量的水,充分搅拌,静置后,观察到上层溶液呈无色,烧杯底部有蓝白色固体;过滤.
②向上述滤液中滴加几滴硝酸银溶液,溶液变浑浊.
③将上述滤渣投入盛有足量稀盐酸的烧杯中,充分搅拌,有无色无味的气体产生.烧杯底部有白色固体剩余.
则下列说法正确的是( )
| A. | 白色粉末中可能有氯化钠和碳酸钙 | |
| B. | 白色粉末中肯定没有氢氧化钠和碳酸氢铵,可能有氯化钠 | |
| C. | 白色粉末中肯定有氯化钡、氢氧化钠、无水硫酸铜和碳酸钙 | |
| D. | 白色粉末中肯定有氢氧化钠和无水硫酸铜,且二者的质量比一定为1:2 |
19.金属材料有着广泛的用途.
(1)图1所示用品中,利用金属导电性的是B(填字母序号).
(2)下表是一些金属的熔点数据.

铅锡合金中某种金属的质量分数与合金的熔点有如图2所示的关系,其中横坐标表示的是Sn(填化学式)的质量分数;当合金熔点最低时,合金中铅与锡的质量比为2:3.
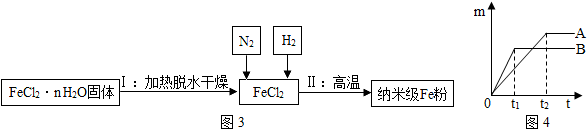
(3)新型材料纳米级Fe粉在空气中易自燃,能用作高效催化剂,实验室采用还原法制备纳米级Fe粉,流程如图3:
①铁丝在空气中只能灼成红热、离火变冷,而纳米级Fe粉在空气中易自燃,说明物质燃烧的剧烈程度与药品的状态(可燃物与氧气的接触面积)有关.
②写出Ⅱ中用氢气从FeCl2置换出铁的反应方程式H2+FeCl2$\frac{\underline{\;高温\;}}{\;}$Fe+2HCl.
在Ⅱ中通入氮气的目的是排尽空气,防止生成的铁粉被反应.
(4)一般情况下,两种活动性不同的金属在潮湿的环境中接触时,活动性较强的金属首先被腐蚀.造船工业为避免轮船的钢铁外壳被腐蚀,通常在轮船外壳镶嵌的金属是D.(填编号)
A、银块 B、铜块 C、锡块 D、锌块
(5)用下列试剂探究不同金属与酸反应的速率不同:锌片、铁片、5%盐酸.取质量相等的上述两种金属(表面积相同),分别放入溶质质量分数5%的足量稀盐酸中.
①线B对应的金属是Zn.
②线A对应的金属与稀盐酸反应的化学方程式Fe+2HCl═FeCl2+H2↑.
(6)某兴趣小组的同学将一块不纯的铁片5.6g投入到足量的稀盐酸中,充分反应后生成了0.2g气体,则该铁片中混有的杂质一定不可能是D.
A、铝和锌 B、镁和锌 C、镁和铜 D、锌和铜.
(1)图1所示用品中,利用金属导电性的是B(填字母序号).
(2)下表是一些金属的熔点数据.

| 金属 | 铜 | 锌 | 锡 | 铅 | 铋 | 镉 |
| 熔点/℃ | 1083 | 419.6 | 231.9 | 327.5 | 271.3 | 320.9 |
(3)新型材料纳米级Fe粉在空气中易自燃,能用作高效催化剂,实验室采用还原法制备纳米级Fe粉,流程如图3:
①铁丝在空气中只能灼成红热、离火变冷,而纳米级Fe粉在空气中易自燃,说明物质燃烧的剧烈程度与药品的状态(可燃物与氧气的接触面积)有关.
②写出Ⅱ中用氢气从FeCl2置换出铁的反应方程式H2+FeCl2$\frac{\underline{\;高温\;}}{\;}$Fe+2HCl.
在Ⅱ中通入氮气的目的是排尽空气,防止生成的铁粉被反应.
(4)一般情况下,两种活动性不同的金属在潮湿的环境中接触时,活动性较强的金属首先被腐蚀.造船工业为避免轮船的钢铁外壳被腐蚀,通常在轮船外壳镶嵌的金属是D.(填编号)
A、银块 B、铜块 C、锡块 D、锌块
(5)用下列试剂探究不同金属与酸反应的速率不同:锌片、铁片、5%盐酸.取质量相等的上述两种金属(表面积相同),分别放入溶质质量分数5%的足量稀盐酸中.

①线B对应的金属是Zn.
②线A对应的金属与稀盐酸反应的化学方程式Fe+2HCl═FeCl2+H2↑.
(6)某兴趣小组的同学将一块不纯的铁片5.6g投入到足量的稀盐酸中,充分反应后生成了0.2g气体,则该铁片中混有的杂质一定不可能是D.
A、铝和锌 B、镁和锌 C、镁和铜 D、锌和铜.
18.CaO和NaOH固体的混合物,俗名“碱石灰”,实验室常用作干燥剂.碱石灰在空气久置会吸收空气中的水和二氧化碳而变质.某实验小组为确定一瓶久置的碱石灰样品的成分,设计了如图所示实验流程. 请你参与探究过程:

(1)为了使样品充分溶解,操作一定还要用到的玻璃仪器是玻璃棒;操作二的名称是过滤.
(2)固体A中可能含有氢氧化钙,理由是氢氧化钙微溶于水.
(3)通过固体A与稀盐酸反应的实验现象,小明认为原固体样品中一定含有碳酸钙,但小军认为小明的结论不合理,其理由可能是碳酸钠与氢氧化钙发生反应生成了碳酸钙.
(4)溶液B成分的探究.
【查阅资料】
①Ca(OH)2、Na2CO3溶于水无明显的温度变化;
②BaCI2溶液呈中性.
【猜想】
溶液B中溶质可能为:①NaOH; ②Na2CO3; ③NaOH和Na2CO3;④Ca(OH)2和NaOH
【进行实验】
小明、小军同学分别设计如下方案并进行探究:
小明:取少量溶液B于试管中,滴加足量的稀盐酸,产生大量气泡,则溶液B中的溶质是Na2CO3.
小红:认真分析上述二位同学的实验,认为他们的结论均有不足之处,并且做出了正确的判断.他认为B溶液中一定含有Na2CO3,可能含有NaOH.为进一步确认溶液B中是否含NaOH,她做了如下实验.
实验步骤①的目的是检验并除尽溶液B中的碳酸钠,避免干扰氢氧化钠的检验.
【实验分析】
实验过程中,同学们发现向样品中加水时还放出大量的热.综合以上探究,下列对样品成分分析正确的是BD(填序号).
A.一定有NaOH B.一定有Na2CO3 C.一定有CaO D.至少有NaOH、CaO中的一种.
0 164394 164402 164408 164412 164418 164420 164424 164430 164432 164438 164444 164448 164450 164454 164460 164462 164468 164472 164474 164478 164480 164484 164486 164488 164489 164490 164492 164493 164494 164496 164498 164502 164504 164508 164510 164514 164520 164522 164528 164532 164534 164538 164544 164550 164552 164558 164562 164564 164570 164574 164580 164588 211419

(1)为了使样品充分溶解,操作一定还要用到的玻璃仪器是玻璃棒;操作二的名称是过滤.
(2)固体A中可能含有氢氧化钙,理由是氢氧化钙微溶于水.
(3)通过固体A与稀盐酸反应的实验现象,小明认为原固体样品中一定含有碳酸钙,但小军认为小明的结论不合理,其理由可能是碳酸钠与氢氧化钙发生反应生成了碳酸钙.
(4)溶液B成分的探究.
【查阅资料】
①Ca(OH)2、Na2CO3溶于水无明显的温度变化;
②BaCI2溶液呈中性.
【猜想】
溶液B中溶质可能为:①NaOH; ②Na2CO3; ③NaOH和Na2CO3;④Ca(OH)2和NaOH
【进行实验】
小明、小军同学分别设计如下方案并进行探究:
小明:取少量溶液B于试管中,滴加足量的稀盐酸,产生大量气泡,则溶液B中的溶质是Na2CO3.
小红:认真分析上述二位同学的实验,认为他们的结论均有不足之处,并且做出了正确的判断.他认为B溶液中一定含有Na2CO3,可能含有NaOH.为进一步确认溶液B中是否含NaOH,她做了如下实验.
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量溶液B于试管中,加入足量CaCl2溶液; ②过滤,在滤液中滴加酚酞试液 | 有白色沉淀生成,溶液由无色变成红色 | 猜想③正确 |
【实验分析】
实验过程中,同学们发现向样品中加水时还放出大量的热.综合以上探究,下列对样品成分分析正确的是BD(填序号).
A.一定有NaOH B.一定有Na2CO3 C.一定有CaO D.至少有NaOH、CaO中的一种.
 如图是甲、乙、丙三种固体物质的溶解度曲线.
如图是甲、乙、丙三种固体物质的溶解度曲线.