3.在一定条件下,一个密闭容器内发生某反应,测得反应过程中各物质的质量部分数据如下表所示.下列未知数据计算正确的是( )
| 物质 | a | b | c | d |
| 反应前的质量(g) | 10 | 10 | 0 | 0 |
| 反应中的质量(g) | 6 | 2 | 3 | ① |
| 反应后的质量(g) | ② | 0 | ③ | ④ |
| A. | ①为7 | B. | ②为5 | C. | ③为3.75 | D. | ④为16.25 |
2.金属在日常生活、工农业生产和科学研究方面应用广泛.
(1)某实验小组为了探究锌与硫酸反应快慢的影响因素,进行了如下实验.
①用图1装置收集并测量氢气的体积,其中量筒作用是根据进入量筒中水的体积,判断生成氢气的体积,氢气应从f(填e或f或g)管通入.
②要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是①③或②④.
③下表是小兵第①组实验的详细数据.
请描述锌与硫酸反应的快慢的变化由慢到快然后逐渐减慢.
解释原因反应开始放出热量,温度升高,反应由慢到快,随着反应的进行,硫酸被消耗,硫酸溶质质量分数变小反应减慢.
(2)保险粉(化学式 Na2S2O4)在工农业生产中有广泛的用途,Na2S2O4在碱性溶液中稳定,在中性和酸性溶液中极不稳定;在 NaCl 存在下,Na2S2O4在水中溶解度显著下降.Na2S2O4制备流程如图2:
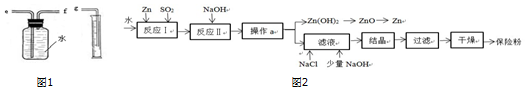
①已知反应Ⅰ的原理为:Zn+2SO2═ZnS2O4,反应Ⅱ为复分解反应,反应Ⅱ的化学方程式为2NaOH+ZnS2O4═Zn(OH)2↓+Na2S2O4.
②操作a的名称为过滤.
③滤液中含有 Na2S2O4,为使 Na2S2O4结晶析出还需要加入少量 NaOH 的原因是Na2S2O4在碱性溶液中稳定,加入NaCl的原因是降低 Na2S2O4在水中的溶解度.
④198gZn(OH)2理论上能得到Zn的质量为130g.
(1)某实验小组为了探究锌与硫酸反应快慢的影响因素,进行了如下实验.
| 实验编号 | 硫酸的质量分数 (均取20mL) | 锌的形状 (均取1g) | 氢气的体积(mL) (均收集3分钟) |
| ① | 20% | 锌粒 | 31.7 |
| ② | 20% | 锌片 | 50.9 |
| ③ | 30% | 锌粒 | 61.7 |
| ④ | 30% | 锌片 | 79.9 |
②要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是①③或②④.
③下表是小兵第①组实验的详细数据.
| 时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
解释原因反应开始放出热量,温度升高,反应由慢到快,随着反应的进行,硫酸被消耗,硫酸溶质质量分数变小反应减慢.
(2)保险粉(化学式 Na2S2O4)在工农业生产中有广泛的用途,Na2S2O4在碱性溶液中稳定,在中性和酸性溶液中极不稳定;在 NaCl 存在下,Na2S2O4在水中溶解度显著下降.Na2S2O4制备流程如图2:

①已知反应Ⅰ的原理为:Zn+2SO2═ZnS2O4,反应Ⅱ为复分解反应,反应Ⅱ的化学方程式为2NaOH+ZnS2O4═Zn(OH)2↓+Na2S2O4.
②操作a的名称为过滤.
③滤液中含有 Na2S2O4,为使 Na2S2O4结晶析出还需要加入少量 NaOH 的原因是Na2S2O4在碱性溶液中稳定,加入NaCl的原因是降低 Na2S2O4在水中的溶解度.
④198gZn(OH)2理论上能得到Zn的质量为130g.
1.化学兴趣小组的同学对影响锌与稀硫酸反应速率的因素进行探究.
【猜想与假设】假设一:与反应初温有关;
猜想二:与稀硫酸的浓度有关
【实验探究】
用砂纸打磨锌片,进行下列实验.打磨的目的是除去锌片表面的杂质.
(1)小组的同学用相同质量的锌片与相同体积的稀硫酸进行反应,探究过程如下:
(2)写出锌与稀硫酸反应的化学方程式Zn+H2SO4═ZnSO4+H2↑.
【实验结论】
(3)实验②和③比较,锌与稀硫酸反应与温度有关.
(4)通过实验①和②比较,结论相同条件下,稀硫酸的浓度越大,反应速率越快.
(5)上述实验最好选用收集方法排水,除了上述的测量方法以外,还可以通过测量收集相同体积的气体所需的时间,也可以达到实验目的.
【反思与评价】
(6)实验①后测得溶液的初温为30℃,该反应属于放热(填“吸热”或“放热”)反应.
(7)你认为影响锌与稀硫酸反应速率的因素还有哪些?并设计实验方案常温下,取质量相同的锌片和锌粒分别放入到体积和浓度相同的稀硫酸中,测量在相同时间内收集气体的体积.
【猜想与假设】假设一:与反应初温有关;
猜想二:与稀硫酸的浓度有关
【实验探究】
用砂纸打磨锌片,进行下列实验.打磨的目的是除去锌片表面的杂质.
(1)小组的同学用相同质量的锌片与相同体积的稀硫酸进行反应,探究过程如下:
| 反应初温/℃ | 锌的形状 | 稀硫酸的浓度/% | 气体的体积/Ml(收集3分钟) | |
| ① | 20 | 锌片 | 20 | 40 |
| ② | 20 | 锌片 | 30 | 55 |
| ③ | 30 | 锌片 | 30 | 62 |
【实验结论】
(3)实验②和③比较,锌与稀硫酸反应与温度有关.
(4)通过实验①和②比较,结论相同条件下,稀硫酸的浓度越大,反应速率越快.
(5)上述实验最好选用收集方法排水,除了上述的测量方法以外,还可以通过测量收集相同体积的气体所需的时间,也可以达到实验目的.
【反思与评价】
(6)实验①后测得溶液的初温为30℃,该反应属于放热(填“吸热”或“放热”)反应.
(7)你认为影响锌与稀硫酸反应速率的因素还有哪些?并设计实验方案常温下,取质量相同的锌片和锌粒分别放入到体积和浓度相同的稀硫酸中,测量在相同时间内收集气体的体积.
18.将某种盐溶于水后分成两份,一份加入氢氧化钠溶液,生成红褐色沉淀,另一份加入硝酸银溶液,生成不溶于稀硝酸的白色沉淀,则该盐为( )
| A. | CuSO4 | B. | FeCl3 | C. | Fe(NO3)3 | D. | Fe2O3 |
17.某同学为了探究酸和碱的反应,按下列要求进行了实验的设计与分析:
【实验目的】证明酸和碱发生了中和反应.
【演示实验】将一定量的稀硫酸加入到盛有NaOH溶液的小烧杯中.
【实验原理】该反应的化学方程式为2NaOH+H2SO4=Na2SO4+2H2O.
【提出问题】实验中未观察到明显现象,该同学产生了疑问:反应后溶液中的溶质是什么呢?
【实验探究】该同学又选取了BaCl2、酚酞、紫色石蕊溶液设计实验,分别探究上述酸、碱反应后烧杯中溶液中的溶质,取烧杯中溶液,按下列方案进行实验:
①设计的三个方案中,有一个错误的方案是:方案一,该方案错误的原因是即使稀硫酸不过量,也会出现白色沉淀,因为溶液中有生成的硫酸钠,存在硫酸根离子;
②请你简单设计实验对上述错误方案进行更正:取样,滴入几滴紫色石蕊溶液,液变红,溶液呈酸性,说明硫酸过量.
【实验目的】证明酸和碱发生了中和反应.
【演示实验】将一定量的稀硫酸加入到盛有NaOH溶液的小烧杯中.
【实验原理】该反应的化学方程式为2NaOH+H2SO4=Na2SO4+2H2O.
【提出问题】实验中未观察到明显现象,该同学产生了疑问:反应后溶液中的溶质是什么呢?
【实验探究】该同学又选取了BaCl2、酚酞、紫色石蕊溶液设计实验,分别探究上述酸、碱反应后烧杯中溶液中的溶质,取烧杯中溶液,按下列方案进行实验:
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 硫酸过量 |
| 方案二 | 取样,滴入几滴紫色石蕊溶液 | 溶液颜色为紫色 | 酸碱恰好完全反应 |
| 方案三 | 取样,滴入几滴无色酚酞溶液 | 溶液变红 | 氢氧化钠过量,溶质为氢氧化钠和硫酸钠 |
②请你简单设计实验对上述错误方案进行更正:取样,滴入几滴紫色石蕊溶液,液变红,溶液呈酸性,说明硫酸过量.
15.化学源于生活,它与我们生活息息相关.请从以下物质中选择正确序号填空:
A、石墨B、硝酸铵(NH4NO3) C、甲烷 D、食醋E、硝酸钾(KNO3) F、二氧化硫
(1)新农村建设中,许多家庭建了沼气池.沼气的主要成分是C.
(2)烧水壶用久了内壁会出现水垢,厨房中除水垢可用D.
(3)农业常用作复合肥的是E.
(4)请从A-F中选择符合下表类别的物质,用其化学式填空(每空只填一个化学式):
0 159573 159581 159587 159591 159597 159599 159603 159609 159611 159617 159623 159627 159629 159633 159639 159641 159647 159651 159653 159657 159659 159663 159665 159667 159668 159669 159671 159672 159673 159675 159677 159681 159683 159687 159689 159693 159699 159701 159707 159711 159713 159717 159723 159729 159731 159737 159741 159743 159749 159753 159759 159767 211419
A、石墨B、硝酸铵(NH4NO3) C、甲烷 D、食醋E、硝酸钾(KNO3) F、二氧化硫
(1)新农村建设中,许多家庭建了沼气池.沼气的主要成分是C.
(2)烧水壶用久了内壁会出现水垢,厨房中除水垢可用D.
(3)农业常用作复合肥的是E.
(4)请从A-F中选择符合下表类别的物质,用其化学式填空(每空只填一个化学式):
| 类别 | 单质 | 氧化物 | 盐 |
| 化学式 | C | SO2 | KNO3(或NH4NO3) |

