题目内容
2.金属在日常生活、工农业生产和科学研究方面应用广泛.(1)某实验小组为了探究锌与硫酸反应快慢的影响因素,进行了如下实验.
| 实验编号 | 硫酸的质量分数 (均取20mL) | 锌的形状 (均取1g) | 氢气的体积(mL) (均收集3分钟) |
| ① | 20% | 锌粒 | 31.7 |
| ② | 20% | 锌片 | 50.9 |
| ③ | 30% | 锌粒 | 61.7 |
| ④ | 30% | 锌片 | 79.9 |
②要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是①③或②④.
③下表是小兵第①组实验的详细数据.
| 时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
解释原因反应开始放出热量,温度升高,反应由慢到快,随着反应的进行,硫酸被消耗,硫酸溶质质量分数变小反应减慢.
(2)保险粉(化学式 Na2S2O4)在工农业生产中有广泛的用途,Na2S2O4在碱性溶液中稳定,在中性和酸性溶液中极不稳定;在 NaCl 存在下,Na2S2O4在水中溶解度显著下降.Na2S2O4制备流程如图2:
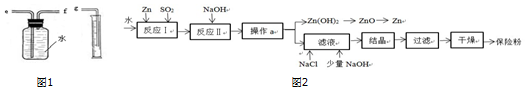
①已知反应Ⅰ的原理为:Zn+2SO2═ZnS2O4,反应Ⅱ为复分解反应,反应Ⅱ的化学方程式为2NaOH+ZnS2O4═Zn(OH)2↓+Na2S2O4.
②操作a的名称为过滤.
③滤液中含有 Na2S2O4,为使 Na2S2O4结晶析出还需要加入少量 NaOH 的原因是Na2S2O4在碱性溶液中稳定,加入NaCl的原因是降低 Na2S2O4在水中的溶解度.
④198gZn(OH)2理论上能得到Zn的质量为130g.
分析 (1)①根据进入量筒中水的体积,等于生成氢气的体积以及氢气的密度小于水的密度进行解答;
②根据比较不同质量分数的硫酸对反应快慢的影响,需要控制硫酸的浓度不同进行解答;
③根据实验现象进行解答;
(2)①根据复分解反应的含义进行解答;
②根据过滤可用于固体物质的分离进行解答;
③根据Na2S2O4在碱性溶液中稳定以及加入NaCl的原因是降低 Na2S2O4在水中的溶解度进行解答;
④根据元素守恒进行解答.
解答 解:(1)①根据进入量筒中水的体积,等于生成氢气的体积,氢气的密度小于水的密度,所以氢气应从f管通入;
②根据比较不同质量分数的硫酸对反应快慢的影响,需要控制硫酸的浓度不同,所以要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是①③或②④;
③根据实验现象可知,锌与硫酸反应的快慢的变化由慢到快然后逐渐减慢,原因:反应开始放出热量,温度升高,反应由慢到快,随着反应的进行,硫酸被消耗,硫酸溶质质量分数变小反应减慢;
(2)①根据复分解反应的含义可知,反应Ⅱ的化学方程式为2NaOH+ZnS2O4═Zn(OH)2↓+Na2S2O4;
②过滤可用于固体物质的分离,所以操作a的名称为过滤;
③Na2S2O4在碱性溶液中稳定,所以为使 Na2S2O4结晶析出还需要加入少量 NaOH;加入NaCl的原因是降低 Na2S2O4在水中的溶解度,所以加入NaCl;
④根据元素守恒可知,198gZn(OH)2理论上能得到Zn的质量=$\frac{65}{65+(16+1)×2}×100%$=130g.
故答案为:(1)①根据进入量筒中水的体积,判断生成氢气的体积;f;②①③或②④;
③由慢到快然后逐渐减慢;反应开始放出热量,温度升高,反应由慢到快,随着反应的进行,硫酸被消耗,硫酸溶质质量分数变小反应减慢;
(2)①2NaOH+ZnS2O4═Zn(OH)2↓+Na2S2O4; ②过滤;③Na2S2O4在碱性溶液中稳定;降低 Na2S2O4在水中的溶解度; ④130g.
点评 本题考查的是实验速率的实验探究,完成此题,可以依据已有的知识进行.

| A. | 苯中的C、H元素的质量比为12:1 | |
| B. | 苯是由6个碳元素和6个氢元素组成 | |
| C. | 苯分子中碳的原子结构示意图为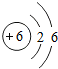 | |
| D. | 苯中碳、氢元素均位于元素周期表的第二周期 |
【实验目的】证明酸和碱发生了中和反应.
【演示实验】将一定量的稀硫酸加入到盛有NaOH溶液的小烧杯中.
【实验原理】该反应的化学方程式为2NaOH+H2SO4=Na2SO4+2H2O.
【提出问题】实验中未观察到明显现象,该同学产生了疑问:反应后溶液中的溶质是什么呢?
【实验探究】该同学又选取了BaCl2、酚酞、紫色石蕊溶液设计实验,分别探究上述酸、碱反应后烧杯中溶液中的溶质,取烧杯中溶液,按下列方案进行实验:
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 硫酸过量 |
| 方案二 | 取样,滴入几滴紫色石蕊溶液 | 溶液颜色为紫色 | 酸碱恰好完全反应 |
| 方案三 | 取样,滴入几滴无色酚酞溶液 | 溶液变红 | 氢氧化钠过量,溶质为氢氧化钠和硫酸钠 |
②请你简单设计实验对上述错误方案进行更正:取样,滴入几滴紫色石蕊溶液,液变红,溶液呈酸性,说明硫酸过量.
| A. | 碳酸钠在水中能直接解离出OH- | |
| B. | 往碳酸钠溶液中加稀硫酸后溶液的pH减小 | |
| C. | 碳酸钠溶液中存在OH- | |
| D. | 往碳酸钠溶液中滴加紫色石蕊试液后溶液显蓝色 |
| A. | 氮气 | B. | 氧气 | C. | 稀有气体 | D. | 二氧化碳 |
 分别表示X、Y、Z三种不溶的气体分子,其在一定条件下反应,前后的变化如图所示,下列叙述错误的是( )
分别表示X、Y、Z三种不溶的气体分子,其在一定条件下反应,前后的变化如图所示,下列叙述错误的是( )
| A. | 该反应为化合反应 | B. | 一个Z分子由四个原子构成 | ||
| C. | 该反应中X、Y、Z分子个数比为4:1:2 | D. | 反应后方框内有两种物质 |
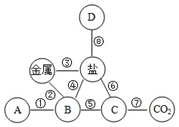 如图是小李同学构建的知识网络,其中A、B、C、D分别表示不同类别的化合物,“-”表示物质之间能够发生化学反应.请按要求回答下列问题:
如图是小李同学构建的知识网络,其中A、B、C、D分别表示不同类别的化合物,“-”表示物质之间能够发生化学反应.请按要求回答下列问题: