9.生活中处处有化学,下列说法正确的是( )
| A. | 活性炭可以将硬水软化 | |
| B. | 湿衣服在阳光下比阴凉处干得快,原因是水分子受热后运动速率加快 | |
| C. | 可用打火机检查天然气是否泄露 | |
| D. | 过氧化氢分子能分解成水分子和氧分子,说明分子是化学变化中的最小微粒 |
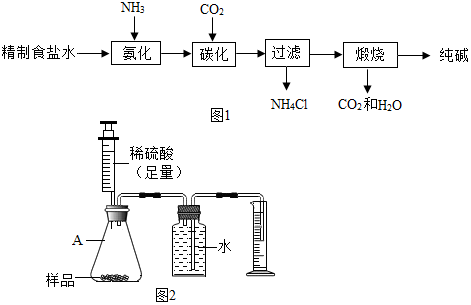
5.爱国科学家侯德榜先生发明了侯氏制碱法,为我国民族工业的发展做出了接触的贡献.该方法是将CO2和NH3通过饱和的NaCl溶液充分反应,其中的一步反应是NH4HCO3+NaCl═NaHCO3↓+NH4Cl,下列叙述错误的是( )
| A. | 该反应不符合复分解反应发生的条件 | |
| B. | 该反应中四种物质都是盐 | |
| C. | 反应后可用过滤的方法分离出NaHCO3 | |
| D. | 反应后的溶液中还能继续溶解NaCl |
20.下列四个图象中,能正确反映对应变化关系( )
0 158064 158072 158078 158082 158088 158090 158094 158100 158102 158108 158114 158118 158120 158124 158130 158132 158138 158142 158144 158148 158150 158154 158156 158158 158159 158160 158162 158163 158164 158166 158168 158172 158174 158178 158180 158184 158190 158192 158198 158202 158204 158208 158214 158220 158222 158228 158232 158234 158240 158244 158250 158258 211419
 |  |  |  |
| A.向一定量的稀盐酸中加入氧化铁 | B.向一定量的氢氧化钠溶液中滴加稀盐酸 | C.向一定量的硫酸铜溶液中加入铁粉 | D.向一定量的氢氧化钠和氢氧化钙的混合溶液中通入二氧化碳 |
| A. | A | B. | B | C. | C | D. | D |