题目内容
4.请根据如图所示的实验过程和提供的数据,计算样品中钠元素的质量.
(1)反应产生的CO2的质量为4.4g.
(2)若已知样品质量为50.6g,其中Na元素的质量是多少?(写出计算过程)
分析 稀硫酸和氢氧化钠反应生成硫酸钠和水,和碳酸钠反应生成硫酸钠、水和二氧化碳,反应前后的质量差即为反应生成二氧化碳质量,根据二氧化碳质量可以计算碳酸钠质量,进一步可以计算氢氧化钠质量,从而可以计算样品中钠元素的质量.
解答 解:(1)反应产生的CO2的质量为:200g+200g-395.6g=4.4g.
故填:4.4.
(2)设碳酸钠质量为x,
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O,
106 44
x 4.4g
$\frac{106}{x}$=$\frac{44}{4.4g}$,
x=10.6g,
样品中钠元素的质量为:10.6g×$\frac{46}{106}$×100%+(50.6g-10.6g)×$\frac{23}{40}$×100%═27.6g,
答:样品中钠元素的质量为27.6g.
点评 差量法在计算中的应用很广泛,解答的关键是要分析出物质的质量差与要求的未知数之间的关系,再根据具体的数据求解.

练习册系列答案
相关题目
19. 如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法不正确的是( )
如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法不正确的是( )
 如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法不正确的是( )
如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法不正确的是( )| A. | 将丙物质饱和溶液变为不饱和溶液,可采用降温方法 | |
| B. | 70℃时,分别用100g水配制甲、乙的饱和溶液,再降温到20℃,析出无水晶体的质量:甲>乙 | |
| C. | 50℃时,将等质量的甲、乙、丙三种固体分别配制成饱和溶液,需加水质量最多的是丙 | |
| D. | 将40℃时甲、乙、丙的饱和溶液分别升温至60℃,所得溶液的溶质质量分数由大到小的顺序是:乙>甲=丙 |
20.关于H2O和H2O2的比较,不正确的是( )
| A. | 都含有氢、氧元素 | |
| B. | 都由氢、氧原子构成,结构相同 | |
| C. | 一定条件下都能分解产生氧气 | |
| D. | H2O是常见的溶剂,H2O2溶液可用于医疗消毒 |
12.下列属于化学变化的是( )
| A. | 冰雪融化 | B. | 水分蒸发 | C. | 纸张燃烧 | D. | 矿石粉碎 |
19.下列反应中,不属于复分解反应的是( )
| A. | MgCl2+2NaOH═Mg(OH)2↓+2NaCl | B. | Na2CO3+Ca(OH)2═CaCO3↓+2NaOH | ||
| C. | 2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑ | D. | CaO+2HCl═CaCl2+H2O |
9.生活中处处有化学,下列说法正确的是( )
| A. | 活性炭可以将硬水软化 | |
| B. | 湿衣服在阳光下比阴凉处干得快,原因是水分子受热后运动速率加快 | |
| C. | 可用打火机检查天然气是否泄露 | |
| D. | 过氧化氢分子能分解成水分子和氧分子,说明分子是化学变化中的最小微粒 |
13.关于化学反应“甲+乙→丙+丁”的分析正确的是( )
| A. | 若甲、乙各取10g混合,使其充分反应,则丙、丁质量的总和一定等于20g | |
| B. | 若丙为沉淀,则甲、乙中有一种物质是碱 | |
| C. | 若该反应为复分解反应,则生成物中一定有水 | |
| D. | 若乙和丁为单质,甲和丙为化合物,则该反应一定为置换反应 |
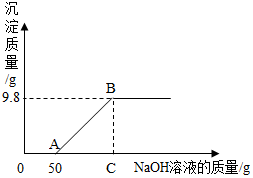 现有硫酸和硫酸铜的混合溶液200g,向该溶液中逐滴加入质量分数为10%的氢氧化钠溶液直至生成Cu(OH)2沉淀,沉淀质量与所加入的氢氧化钠溶液的质量关系如图所示.求:
现有硫酸和硫酸铜的混合溶液200g,向该溶液中逐滴加入质量分数为10%的氢氧化钠溶液直至生成Cu(OH)2沉淀,沉淀质量与所加入的氢氧化钠溶液的质量关系如图所示.求: