18.除去物质中的杂质,下列方法一定能够达到实验目的是( )
| A. | 氯化钠溶液中混有少量的了氯化铜--加入过量的氢氧化钠溶液过滤 | |
| B. | 二氧化碳气体混有少量氯化氢--将气体通过氢氧化钠溶液 | |
| C. | 氯化亚铁溶液中混有少量的氯化铜--加入过量铁粉过滤 | |
| D. | 生石灰中混有少量的石灰石--加入稀盐酸 |
17.密闭容器中有X、Y、Z、W四种物质,在一定条件下完全发生反应后,测得数据如表,下列说法正确的是
( )
| 物 质 | X | Y | Z | W |
| 反应前质量/g | 10 | m | 8 | 7 |
| 反应后质量/g | 2 | 3 | 30 | 25 |
| A. | 若W为水,则X或Y必定为酸或碱 | |
| B. | 若Z为化合物,W为单质,则该反应一定为置换反应 | |
| C. | 若X、Y、Z、W均为化合物,则该反应一定为复分解反应 | |
| D. | 参加反应的X和Y的质量比为1:4 |
16.下列实验操作中,正确的是( )
| A. |  | B. |  | ||
| C. |  | D. |  过滤 |
15.化学与生活密切相关,从化学的角度认识生活中的问题,下列说法不正确的是( )
| A. | 电器起火应立即切断电源 | B. | 人体缺铁会导致甲状腺肿大 | ||
| C. | 可用熟石灰改良酸性土壤 | D. | 生活中常用煮沸的方法软化硬水 |
14.锌及其氧化物(ZnO,白色,难溶于水,溶于强酸)具有广泛的应用.
(一)锌的广泛应用
(1)锌被称之为“生命元素”.儿童、青少年如果缺锌严重,将会导致食欲不振和智力发育不良.经常吃贝壳类海产品、红色肉类等含锌的食物有利补“锌”.这里的“锌”是指B.
A.单质 B.元素 C.原子 D.分子
(2)锌与铜熔合可形成“黄铜”,它属于A(选填序号).
A.金属材料 B.无机非金属材料 C.合成材料 D.复合材料
(二)活性ZnO制取的探究
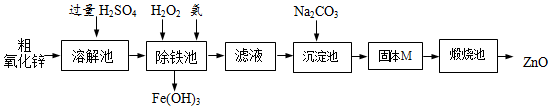
【实验方案】工业上用粗氧化锌(含少量FeO)制取活性氧化锌,其流程如下:
【查阅资料】一些阳离子以氢氧化物形式开始沉淀、完全沉淀时溶液的pH见表.
【问题探究】
(3)“溶解”前将粗氧化锌粉碎成细颗粒,目的是增大接触面积,加快反应速率.
(4)写出在粗ZnO样品中加硫酸发生反应的化学方程式ZnO+H2SO4═ZnSO4+H2O(选写一个).
(5)“溶解”后得到的酸性溶液中含有ZnSO4、H2SO4、FeSO4.除铁池中加入适量H2O2,使Fe2+转化为Fe3+;为使溶液中Fe3+全部转化为Fe(OH)3,而Zn2+不形成Zn(OH)2,则应加入氨水控制溶液的pH的范围为3.2~6.2.
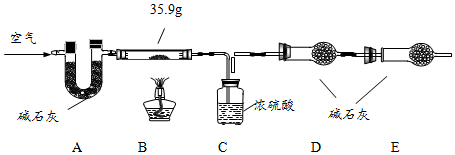
【组成测定】固体B的组成会影响制得的ZnO的活性.为确定aZnCO3•bZn(OH)2•cH2O的组成,进行如下实验(假设每步反应、吸收均完全):
【查阅资料】aZnCO3•bZn(OH)2•cH2O受热分解生成ZnO、H2O、CO2三种产物.
(6)写出装置B中发生反应的化学方程式aZnCO3•bZn(OH)2•cH2O$\frac{\underline{\;\;△\;\;}}{\;}$(a+b)ZnO+aCO2↑+(b+c)H2O .
现称取35.9g aZnCO3•bZn(OH)2•cH2O在B装置中进行完全煅烧,测得装置C和D的质量分别增重7.2g和4.4g.
【实验分析及数据处理】
(7)装置A的作用是除去空气中二氧化碳和水.
(8)根据上述数据,则生成ZnO的质量为24.3 g;a:b:c=1:2:2.
(9)若没有E装置,则测得的a值偏大(填“偏大”、“偏小”或“不变”).
0 157846 157854 157860 157864 157870 157872 157876 157882 157884 157890 157896 157900 157902 157906 157912 157914 157920 157924 157926 157930 157932 157936 157938 157940 157941 157942 157944 157945 157946 157948 157950 157954 157956 157960 157962 157966 157972 157974 157980 157984 157986 157990 157996 158002 158004 158010 158014 158016 158022 158026 158032 158040 211419
(一)锌的广泛应用
(1)锌被称之为“生命元素”.儿童、青少年如果缺锌严重,将会导致食欲不振和智力发育不良.经常吃贝壳类海产品、红色肉类等含锌的食物有利补“锌”.这里的“锌”是指B.
A.单质 B.元素 C.原子 D.分子
(2)锌与铜熔合可形成“黄铜”,它属于A(选填序号).
A.金属材料 B.无机非金属材料 C.合成材料 D.复合材料
(二)活性ZnO制取的探究
【实验方案】工业上用粗氧化锌(含少量FeO)制取活性氧化锌,其流程如下:

【查阅资料】一些阳离子以氢氧化物形式开始沉淀、完全沉淀时溶液的pH见表.
| 沉淀物 | Fe(OH)3 | Zn(OH)2 | Fe(OH)2 |
| 开始沉淀pH | 1.5 | 6.2 | 6.3 |
| 完全沉淀pH | 3.2 | 8.0 | 9.7 |
(3)“溶解”前将粗氧化锌粉碎成细颗粒,目的是增大接触面积,加快反应速率.
(4)写出在粗ZnO样品中加硫酸发生反应的化学方程式ZnO+H2SO4═ZnSO4+H2O(选写一个).
(5)“溶解”后得到的酸性溶液中含有ZnSO4、H2SO4、FeSO4.除铁池中加入适量H2O2,使Fe2+转化为Fe3+;为使溶液中Fe3+全部转化为Fe(OH)3,而Zn2+不形成Zn(OH)2,则应加入氨水控制溶液的pH的范围为3.2~6.2.
【组成测定】固体B的组成会影响制得的ZnO的活性.为确定aZnCO3•bZn(OH)2•cH2O的组成,进行如下实验(假设每步反应、吸收均完全):

【查阅资料】aZnCO3•bZn(OH)2•cH2O受热分解生成ZnO、H2O、CO2三种产物.
(6)写出装置B中发生反应的化学方程式aZnCO3•bZn(OH)2•cH2O$\frac{\underline{\;\;△\;\;}}{\;}$(a+b)ZnO+aCO2↑+(b+c)H2O .
现称取35.9g aZnCO3•bZn(OH)2•cH2O在B装置中进行完全煅烧,测得装置C和D的质量分别增重7.2g和4.4g.
【实验分析及数据处理】
(7)装置A的作用是除去空气中二氧化碳和水.
(8)根据上述数据,则生成ZnO的质量为24.3 g;a:b:c=1:2:2.
(9)若没有E装置,则测得的a值偏大(填“偏大”、“偏小”或“不变”).
 A、B、C三种物质的溶解度曲线如图所示.
A、B、C三种物质的溶解度曲线如图所示.