17.在天平两边托盘中的烧杯中各放入质量和质量分数相同的足量的盐酸,调节天平至平衡,分别向两边烧杯中各加入8g镁和铁,反应完全后天平的指针( )
| A. | 偏向加铁的一边 | B. | 偏向加镁的一边 | ||
| C. | 停留在原位 | D. | 不能确定偏向哪边 |
16.某校学生在探究金属的化学性质时,实验情况如下:
[提出问题]从上述实验现象中,你发现了什么问题?铝和稀硫酸反应为什么没有气泡产生[猜想]针对你发现的问题,分析其原因,大胆提出你的一个猜想:
[设计方案]根据你的猜想,任选下列实验用品,进行实验设计.
实验用品:10%的稀硫酸、30%的稀硫酸、相同大小的铝片(若干)、氯化钠试管、试管夹、酒精灯、镊子、药匙、砂纸
[提出问题]从上述实验现象中,你发现了什么问题?铝和稀硫酸反应为什么没有气泡产生[猜想]针对你发现的问题,分析其原因,大胆提出你的一个猜想:
[设计方案]根据你的猜想,任选下列实验用品,进行实验设计.
实验用品:10%的稀硫酸、30%的稀硫酸、相同大小的铝片(若干)、氯化钠试管、试管夹、酒精灯、镊子、药匙、砂纸
| 实验操作 | 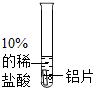 |  |
| 实验现象 | 铝片表面有气泡产生 | 没有明显现象 |
| 操作步骤(用图示说明或文字叙述均可) | 可能观察到的实验现象 | 相应的结论 |
| 用砂纸把铝片打磨后放入10%的稀硫酸中 | 铝片表面有气泡产生 | 我的猜想正确 |
15.化学实验中常常会出现意外情况,这是提升我们学科素养的良好机会,要根据具体情况区别对待,善于发现和解决问题.例如:小婧同学在空气中点燃镁条时,却发现在生成的白色固体中还夹杂着少量的淡黄色固体.
[提出问题]为什么会生成淡黄色固体?[查阅资料]小婧查阅资料,记录了下列几种物质的颜色:
其他同学认为不必查阅氯化镁的颜色,理是镁和空气中的物质都不含有氯元素;
[提出猜想]小婧认为淡黄色固体可能是由镁与空气中的氮气反应生成的;
[实验探究]小婧设计实验证实了自己的猜想,她的方案可能实验步骤:点燃镁条,迅速伸入盛有氮气的集气瓶中;
实验现象:镁条继续燃烧,生成淡黄色固体;
实验结论:镁能和氮气反应生成氮化镁;
[实验结论]根据小婧的实验结果,写出镁条在空气中燃烧时两个反应的化学方程式:2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO、3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2
[反思与评价]通过上述实验,你对燃烧有什么新的认识?燃烧不一定需要氧气参加.
[提出问题]为什么会生成淡黄色固体?[查阅资料]小婧查阅资料,记录了下列几种物质的颜色:
| 物 质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
| 颜 色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 | 白色 |
[提出猜想]小婧认为淡黄色固体可能是由镁与空气中的氮气反应生成的;
[实验探究]小婧设计实验证实了自己的猜想,她的方案可能实验步骤:点燃镁条,迅速伸入盛有氮气的集气瓶中;
实验现象:镁条继续燃烧,生成淡黄色固体;
实验结论:镁能和氮气反应生成氮化镁;
[实验结论]根据小婧的实验结果,写出镁条在空气中燃烧时两个反应的化学方程式:2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO、3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2
[反思与评价]通过上述实验,你对燃烧有什么新的认识?燃烧不一定需要氧气参加.
14.焊接或切割金属常用氧炔焰.氧炔焰是乙炔(C2H2)气体和氧气反应产生的3000°C以上的高温火焰.乙炔由固体碳化钙(化学式为CaC2)与水反应制得,同时生成一种白色固体.
【提出问题】白色固体是什么物质?
【进行猜想】刘平同学认为有以下几种可能:
想一:CaO;猜想二:CaCO3;猜想三:Ca(OH)2.
的依据是根据质量守恒定律.
【交流评价】经过同学交流讨论,认为猜想一成立.否定猜想一的理由是:氧化钙与水反应也生成氢氧化钙.
【交流评价】
【实验结论】白色固体是Ca(OH)2.
出碳化钙与水反应制取乙炔的化学方程式:CaC2+2H2O=Ca(OH)2+C2H2↑.
【提出问题】白色固体是什么物质?
【进行猜想】刘平同学认为有以下几种可能:
想一:CaO;猜想二:CaCO3;猜想三:Ca(OH)2.
的依据是根据质量守恒定律.
【交流评价】经过同学交流讨论,认为猜想一成立.否定猜想一的理由是:氧化钙与水反应也生成氢氧化钙.
【交流评价】
| 实验操作 | 实验现象 | 结论 | |
| 实验一 | 取样于试管中,滴加稀盐酸 | 猜想二:不成立 | |
| 实验二 | 猜想三:成立 |
出碳化钙与水反应制取乙炔的化学方程式:CaC2+2H2O=Ca(OH)2+C2H2↑.
11.某化学课堂围绕“酸碱反应后,溶液的酸碱性”,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格.
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.在老师引导下,学生写出该反应的化学方程式H2SO4+2NaOH=Na2SO4+2H2O
【提出问题】反应后溶液酸碱性如何?同学们,有猜酸性,有猜碱性,还有猜中性.老师说:实验中未观察到明显现象,应该先从反应后溶液中溶质进行分析.
针对反应后溶液的溶质成分,甲组同学的猜想如下.
【假设猜想】:猜想一:只有Na2SO4猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为不合理的猜想是猜想四.理由是H2SO4和NaOH在溶液中不能共存.
【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴酚酞溶液,无明显变化.认定溶液中一定没有NaOH.
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究.已知BaCl2与Na2SO4和H2SO4均能反应,方程式为:BaCl2+Na2SO4═BaSO4↓+2NaCl,BaCl2+H2SO4═BaSO4═BaSO4↓+2HCl
【得出结论】通过探究,全班同学一致确定猜想二是正确的.
【评价反思】老帅对同学们能用多种方法进行探究并且得出正确结论给予肯定.但同时指出:在【实验探究】(2)中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:第一,实验操作中的错误是pH试纸浸入溶液中.第二,实验方案高计错误的是Na2SO4与BaCl2反应也会生成白色沉淀,不能证明一定有H2SO4存在.(填字母)
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.在老师引导下,学生写出该反应的化学方程式H2SO4+2NaOH=Na2SO4+2H2O
【提出问题】反应后溶液酸碱性如何?同学们,有猜酸性,有猜碱性,还有猜中性.老师说:实验中未观察到明显现象,应该先从反应后溶液中溶质进行分析.
针对反应后溶液的溶质成分,甲组同学的猜想如下.
【假设猜想】:猜想一:只有Na2SO4猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为不合理的猜想是猜想四.理由是H2SO4和NaOH在溶液中不能共存.
【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴酚酞溶液,无明显变化.认定溶液中一定没有NaOH.
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究.已知BaCl2与Na2SO4和H2SO4均能反应,方程式为:BaCl2+Na2SO4═BaSO4↓+2NaCl,BaCl2+H2SO4═BaSO4═BaSO4↓+2HCl
| 实验方案 | A 测溶液pH | B滴加Na2CO3溶液 | C滴加BaCl2溶液 |
| 实验操作 | 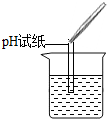 | 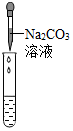 | 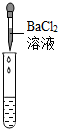 |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 产生有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液显酸性 | 溶液中有H2SO4剩余 | 溶液中有H2SO4剩余 |
【评价反思】老帅对同学们能用多种方法进行探究并且得出正确结论给予肯定.但同时指出:在【实验探究】(2)中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:第一,实验操作中的错误是pH试纸浸入溶液中.第二,实验方案高计错误的是Na2SO4与BaCl2反应也会生成白色沉淀,不能证明一定有H2SO4存在.(填字母)
9.善于梳理有利于知识的系统化,以下归纳完全正确的一组是( )
0 154920 154928 154934 154938 154944 154946 154950 154956 154958 154964 154970 154974 154976 154980 154986 154988 154994 154998 155000 155004 155006 155010 155012 155014 155015 155016 155018 155019 155020 155022 155024 155028 155030 155034 155036 155040 155046 155048 155054 155058 155060 155064 155070 155076 155078 155084 155088 155090 155096 155100 155106 155114 211419
| A物质的分类 | B物质的微观构成 |
| 常见的混合物--空气、溶液、合金 常见的氧化物--冰、干冰、高锰酸钾 常见合金--不锈钢、生铁、黄铜 | 铜--由铜原子构成 水--由水分子构成 氯化钠--由钠离子、氯离子构成 |
| C物质的性质与用途 | D物质的鉴别 |
| CO的还原性--可冶炼金属 O2的助燃性--可用作燃料 洗洁精的乳化用用--除去餐具油污 | 稀盐酸和水--紫色石蕊溶液 氮气和二氧化碳--带火星的木条 铁和铜--观察颜色 |
| A. | A | B. | B | C. | C | D. | D |

 某化学小组在课外活动时按如图所示组装好仪器,在甲试管中装入碳酸钙,乙试管装入紫色石蕊溶液.
某化学小组在课外活动时按如图所示组装好仪器,在甲试管中装入碳酸钙,乙试管装入紫色石蕊溶液.