10.现将粗盐提纯,并用制得的精盐配制质量分数一定的氯化钠溶液.下列说法错误的是( )
| A. | 蒸发滤液时,待蒸发皿中出现较多固体后可进行间歇加热,尽量将水分蒸干 | |
| B. | 配制氯化钠溶液需要经过计算、称量、量取、溶解、装液、贴标签等步骤 | |
| C. | 粗盐溶解和进行过滤操作时,都用到玻璃棒,但玻璃棒的作用不同 | |
| D. | 配制溶液时必备的仪器有托盘天平、滴管、药匙、酒精灯、量筒、烧杯、玻璃棒等 |
7.控制一定条件,Fe2+、H2O2能用于处理含某类有机污染物(用p-CP表示)的废液.某化学兴趣小组的同学在老师的指导下,对该反应中的“一定条件”进行如下的探究.
探究活动一:Fe2+、H2O2处理有机废液的可行性实验
取一定量已知p-CP含量的有机废液(15℃,下称试样),进行如下实验:
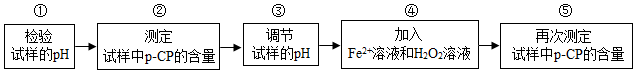
(1)若步骤①测得试样的pH大于7,则步骤③中欲使试样的pH小于7,可加入b(填标号).
a.NaOH溶液 b.稀HCl c.NaCl溶液 d.水
(2)步骤④有多个反应发生,其中产生氧气的化学方程式为2H2O2═2H2O+O2↑.
(3)实验测得试样中p-CP的含量明显减少.请设计一个对比实验证明试样中p-CP含量的减少与产生氧气的反应无关:取样,加入MnO2和H2O2溶液,测得p-CP含量没有变化(或取样,通入氧气,测得p-CP含量没有变化).
探究活动二:影响Fe2+、H2O2处理有机废液的因素探究
将四份相同的试样,控制不同的实验条件(即调节温度为25℃或40℃、pH为10或3),加入Fe2+和H2O2溶液,分别测定试样中p-CP含量随时间的变化情况,所得数据如下表示.
(4)为探究pH对Fe2+、H2O2处理p-CP的反应快慢影响,可比较实验a(填实验编号,下同)和b或c和d.从两组实验对比中得到的结论是pH越小,Fe2+、H2O2处理p-CP的反应速率越快;.
(5)比较实验b和c,可以得到的结论是温度越高,Fe2+、H2O2处理p-CP的反应速率越快.
(6)实验a和d说明pH=10时,Fe2+、H2O2处理p-CP的反应不发生.
(7)实验时需在不同时间从反应器中取样,并使所取样品中反应立即停止下来.根据实验获得的结论,写出一种迅速停止反应的方法:往样品中加入氢氧化钠使溶液的pH等于10(或快速降温).
探究活动一:Fe2+、H2O2处理有机废液的可行性实验
取一定量已知p-CP含量的有机废液(15℃,下称试样),进行如下实验:

(1)若步骤①测得试样的pH大于7,则步骤③中欲使试样的pH小于7,可加入b(填标号).
a.NaOH溶液 b.稀HCl c.NaCl溶液 d.水
(2)步骤④有多个反应发生,其中产生氧气的化学方程式为2H2O2═2H2O+O2↑.
(3)实验测得试样中p-CP的含量明显减少.请设计一个对比实验证明试样中p-CP含量的减少与产生氧气的反应无关:取样,加入MnO2和H2O2溶液,测得p-CP含量没有变化(或取样,通入氧气,测得p-CP含量没有变化).
探究活动二:影响Fe2+、H2O2处理有机废液的因素探究
将四份相同的试样,控制不同的实验条件(即调节温度为25℃或40℃、pH为10或3),加入Fe2+和H2O2溶液,分别测定试样中p-CP含量随时间的变化情况,所得数据如下表示.
| 实验编号 | 温度/℃ | pH | 测得p-CP的含量随时间变化的关系图 |
| a | 25 | 10 | 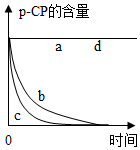 |
| b | 25 | 3 | |
| c | 40 | 3 | |
| d | 40 | 10 |
(5)比较实验b和c,可以得到的结论是温度越高,Fe2+、H2O2处理p-CP的反应速率越快.
(6)实验a和d说明pH=10时,Fe2+、H2O2处理p-CP的反应不发生.
(7)实验时需在不同时间从反应器中取样,并使所取样品中反应立即停止下来.根据实验获得的结论,写出一种迅速停止反应的方法:往样品中加入氢氧化钠使溶液的pH等于10(或快速降温).
5. 某同学进行了如下的探究实验.
某同学进行了如下的探究实验.
实验一:探究稀酸的化学性质(如图).
(1)A试管中的石蕊由紫色变为红色;
(2)通过C,D试管中的现象可得出的结论是酸能与某些金属反应;
(3)E中的固体消失并放热,能否由此证明中和反应的发生,说明理由氢氧化钠溶于水放出大量的热;
(4)补充一个实验,完善酸的通性,写出化学方程式CaCO3+2HCl=CaCl2+H2O+CO2↑.
实验二:实验后的废液处理.
实验结束后,将反应后的废液倒在同一个干净的废液缸中,看到废液浑浊,一段时间后,上层清液为蓝色,下层有难溶固体.
(5)上层清液中的溶质是:石蕊、氢氧化钠、氯化钠;
(6)该同学为验证废液缸中难溶固体的成分,设计了如下实验.
你认为上述结论中正确的是Ⅰ.
 某同学进行了如下的探究实验.
某同学进行了如下的探究实验.实验一:探究稀酸的化学性质(如图).
(1)A试管中的石蕊由紫色变为红色;
(2)通过C,D试管中的现象可得出的结论是酸能与某些金属反应;
(3)E中的固体消失并放热,能否由此证明中和反应的发生,说明理由氢氧化钠溶于水放出大量的热;
(4)补充一个实验,完善酸的通性,写出化学方程式CaCO3+2HCl=CaCl2+H2O+CO2↑.
实验二:实验后的废液处理.
实验结束后,将反应后的废液倒在同一个干净的废液缸中,看到废液浑浊,一段时间后,上层清液为蓝色,下层有难溶固体.
(5)上层清液中的溶质是:石蕊、氢氧化钠、氯化钠;
(6)该同学为验证废液缸中难溶固体的成分,设计了如下实验.
| 实验内容 | 现象 | 难溶固体的成分 |
| 取难溶固体于试管中,加入过量稀盐酸 | 固体部分溶解,溶液变黄 | Ⅰ.一定有铜 Ⅱ.一定有铁 Ⅲ.一定有氧化铁 Ⅳ.至少有三种物质 |
4.据中央电视台2001年6月3日对云南抚仙湖湖底古城考古的现场报道,科学家曾通过对古生物遗骸中的碳-14含量来推断古城的年代.碳-14原子的核电荷数为6,相对原子质量为14.下列关于碳-14原子的说法中,错误的是( )
| A. | 中子数为6 | B. | 质子数为6 | ||
| C. | 电子数为6 | D. | 质子数和中子数之和为14 |
3. 化学兴趣小组对实验室药品柜中的一瓶盐酸的性质和质量分数进行探究,请你参与:
化学兴趣小组对实验室药品柜中的一瓶盐酸的性质和质量分数进行探究,请你参与:
知识回顾 在打开浓盐酸时常会看到瓶口有出现白雾的现象,浓盐酸具有挥发性,导致这瓶盐酸溶液的质量分数变小(填“大”、“小”).
【实验探究Ⅰ】
探究这瓶盐酸的化学性质
(1)请从下列试剂中选择试剂进行检验盐酸的化学性质,填写实验报告:
供选择试剂:石蕊试液、酚酞试液、镁条、铜片、氧化铜、氢氧化钠溶液、硫酸铜溶液
【实验探究Ⅱ】测定这瓶盐酸溶液中溶质的质量分数
【查阅资料】HCl+AgNO3═AgCl↓(白色)+2HNO3
【设计实验】小组同学设计了如下两套方案,请协助他们完成实验方案的设计.
方案Ⅰ往盐酸中加入碳酸钠溶液反应产生气体,通过产生气体的量进行计算.取20mL的盐酸于锥形瓶中,加入足量的碳酸钠溶液并用如图所示装置进行实验:(假设该实验温度下,盐酸的密度均为1g/mL,二氧化碳的密度为2g/L)
(2)实验装置A中发生反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(3)实验过程中,当观察到不产生气泡时,说明加入的碳酸钠已经足量了.
(4)实验前量气管中水的体积为2.0mL,实验结束后量气管中水的体积为222.0mL,则该盐酸溶液中溶质的质量分数是3.65%.
(5)同学经过交流讨论后认为还必须考虑装置A和装置B内原有的气体.你认为装置A和装置B内原有的气体对实验的结果没有(填“有”或“没有”)影响.
方案Ⅱ盐酸中加入硝酸银溶液反应产生沉淀,通过产生沉淀的量进行计算.于是同学们另取一定量的盐酸,按如下流程进行探究:

(6)产生的白色沉淀物质是氯化银.
(7)滴加过量AgNO3溶液的目的是使稀盐酸完全反应.
0 150717 150725 150731 150735 150741 150743 150747 150753 150755 150761 150767 150771 150773 150777 150783 150785 150791 150795 150797 150801 150803 150807 150809 150811 150812 150813 150815 150816 150817 150819 150821 150825 150827 150831 150833 150837 150843 150845 150851 150855 150857 150861 150867 150873 150875 150881 150885 150887 150893 150897 150903 150911 211419
 化学兴趣小组对实验室药品柜中的一瓶盐酸的性质和质量分数进行探究,请你参与:
化学兴趣小组对实验室药品柜中的一瓶盐酸的性质和质量分数进行探究,请你参与:知识回顾 在打开浓盐酸时常会看到瓶口有出现白雾的现象,浓盐酸具有挥发性,导致这瓶盐酸溶液的质量分数变小(填“大”、“小”).
【实验探究Ⅰ】
探究这瓶盐酸的化学性质
(1)请从下列试剂中选择试剂进行检验盐酸的化学性质,填写实验报告:
供选择试剂:石蕊试液、酚酞试液、镁条、铜片、氧化铜、氢氧化钠溶液、硫酸铜溶液
| 实验步骤 | 预计实验现象 |
| 取少量溶液于试管中,滴加石蕊试液 | 溶液变红色 |
| 另取少量溶液于试管中,把镁条伸入溶液中 | 产生气泡 |
【查阅资料】HCl+AgNO3═AgCl↓(白色)+2HNO3
【设计实验】小组同学设计了如下两套方案,请协助他们完成实验方案的设计.
方案Ⅰ往盐酸中加入碳酸钠溶液反应产生气体,通过产生气体的量进行计算.取20mL的盐酸于锥形瓶中,加入足量的碳酸钠溶液并用如图所示装置进行实验:(假设该实验温度下,盐酸的密度均为1g/mL,二氧化碳的密度为2g/L)
(2)实验装置A中发生反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(3)实验过程中,当观察到不产生气泡时,说明加入的碳酸钠已经足量了.
(4)实验前量气管中水的体积为2.0mL,实验结束后量气管中水的体积为222.0mL,则该盐酸溶液中溶质的质量分数是3.65%.
(5)同学经过交流讨论后认为还必须考虑装置A和装置B内原有的气体.你认为装置A和装置B内原有的气体对实验的结果没有(填“有”或“没有”)影响.
方案Ⅱ盐酸中加入硝酸银溶液反应产生沉淀,通过产生沉淀的量进行计算.于是同学们另取一定量的盐酸,按如下流程进行探究:

(6)产生的白色沉淀物质是氯化银.
(7)滴加过量AgNO3溶液的目的是使稀盐酸完全反应.

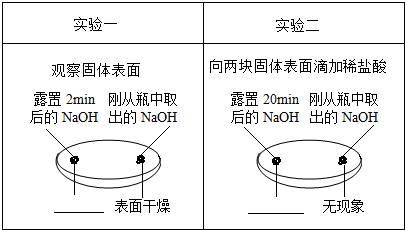
 同学们正在化学实验室完成“实验活动6--酸、碱的化学性质”
同学们正在化学实验室完成“实验活动6--酸、碱的化学性质”