18.下面关于水的作用的说法,错误的是( )
| A. | 工业上要用大量的水来洗涤、溶解、加热和冷却 | |
| B. | 水可以用来发电,作为原料来制造化肥等产品 | |
| C. | 工农业生产用被污染的水并不会降低产品的质量 | |
| D. | 交通运输离不开水,故称长江是水上运输的“黄金渠道” |
17.随着世界人口的急剧增长,工业的蓬勃发展,淡水供应危机日益成为世界关注的焦点.海水约占地球现有总水量的96.5%,海水淡化问题已成为科学家研究的主要方向.若实行海水淡化供应饮用水,下列方法在原理上完全不可行的是( )
| A. | 加明矾,使海水中的盐分沉淀并淡化 | |
| B. | 利用太阳能,将海水蒸馏淡化 | |
| C. | 将海水通过离子交换树脂,以除去所含的盐分 | |
| D. | 利用半透膜,采用反渗透法而使海水淡化 |
15.盐城盛产的松花蛋,又称皮蛋、变蛋.其中一种加工工艺的主要原料配方为:鸭蛋10Kg,水10Kg,生石灰1.2Kg,纯碱0.53Kg,食盐0.35Kg.加工时,将纯碱、食盐加入容器中,加沸水溶解,再慢慢加入生石灰充分反应,冷却后得到料液,再加入鸭蛋浸渍.请回答下列问题:
(1)鸭蛋中富含的营养素有水和蛋白质.
(2)生石灰加入沸水中,水能持续保持沸腾,其原因是生石灰与水反应放出大量的热.
(3)静置后,取少量的上层料液,稀释后滴加无色酚酞试液,料液应变为红色
(4)同学们对上层料液的成分产生了兴趣,请你一起参加他们的探究活动.
【提出问题】料液中含有哪些溶质?
【交流讨论】①一定含有NaOH、NaCl
②可能还含有其它溶质
甲同学推断只有Ca(OH)2
乙同学推断只有Na2CO3
丙同学推断有Ca(OH)2、也有Na2CO3
通过进一步讨论,大家一致认为丙同学的推断是错误的,理由是:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH(用化学方程式表示).
【实验探究】
【探究结论】同学的推断是正确的.
【知识应用】①皮蛋食用时加入一些食醋,可以去除氨味和涩感,原因是酸与碱发生了反应.
(1)鸭蛋中富含的营养素有水和蛋白质.
(2)生石灰加入沸水中,水能持续保持沸腾,其原因是生石灰与水反应放出大量的热.
(3)静置后,取少量的上层料液,稀释后滴加无色酚酞试液,料液应变为红色
(4)同学们对上层料液的成分产生了兴趣,请你一起参加他们的探究活动.
【提出问题】料液中含有哪些溶质?
【交流讨论】①一定含有NaOH、NaCl
②可能还含有其它溶质
甲同学推断只有Ca(OH)2
乙同学推断只有Na2CO3
丙同学推断有Ca(OH)2、也有Na2CO3
通过进一步讨论,大家一致认为丙同学的推断是错误的,理由是:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH(用化学方程式表示).
【实验探究】
| 实验步骤 | 实验现象 |
| 取少量上层料液,滴加稀盐酸 | 无明显现象 |
| 另取少量上层料液,滴加碳酸钠溶液 | 产生白色沉淀 |
【知识应用】①皮蛋食用时加入一些食醋,可以去除氨味和涩感,原因是酸与碱发生了反应.
14.向硫酸铜、锌粉和铁粉的固体混合物中,加入一定量的盐酸,反应停止后过滤,若滤出的滤渣中含有铁粉,则下述结论正确的是( )
| A. | 滤渣中必定含有Zn、Cu,可能含有Fe | |
| B. | 滤渣中必定含有Fe、Zn,可能含有Cu | |
| C. | 滤液中必定含有Zn2+,可能含有Fe2+ | |
| D. | 滤液中必定含有Zn2+、Fe2+,可能含有Cu2+ |
13.某市进行理科实验操作考试,其中化学有关于探究金属的某些物理性质和化学性质的试题,用坩埚钳夹取打磨过的铜片在酒精灯上加热,发现铜片表面变黑,为了探究黑色物质的成分.
[查阅资料]
(1)铜的氧化物主要有两种:CuO(黑色);Cu2O(红色)
(2)酒精在不完全燃烧使会产生炭黑
(3)炭黑不与稀硫酸反应,也不溶于稀硫酸;氧化铜可与稀硫酸反应而溶解
[提出假设]猜想1:黑色物质为氧化铜. 猜想2:黑色物质为炭黑
猜想3:黑色物质为氧化铜与炭黑的混合物
[设计方案]
[得出结论]通过实验现象,得出猜想3成立,此黑色固体为混合物,请写出实验中发生的化学方程式CuO+H2SO4=CuSO4+H2O.
[查阅资料]
(1)铜的氧化物主要有两种:CuO(黑色);Cu2O(红色)
(2)酒精在不完全燃烧使会产生炭黑
(3)炭黑不与稀硫酸反应,也不溶于稀硫酸;氧化铜可与稀硫酸反应而溶解
[提出假设]猜想1:黑色物质为氧化铜. 猜想2:黑色物质为炭黑
猜想3:黑色物质为氧化铜与炭黑的混合物
[设计方案]
| 操作步骤 | 实验中可能出现的现象 | 实验结论 |
| 取少量黑色固体于试管中,加入足量稀硫酸(填物质名称) | ①黑色固体消失,溶液变为蓝色 | 猜想1成立 |
| ②黑色固体没有减少,溶液颜色不变 | 猜想2成立 | |
| ③黑色固体部分消失,溶液变蓝 | 猜想3成立 |
11.某研究性学习小组对“氯碱工业”生产的烧碱样品(可能含有碳酸钠、氯化钠等杂质)进行如下探究.
Ⅰ.定性探究
实验证明
Ⅱ.定量探究:
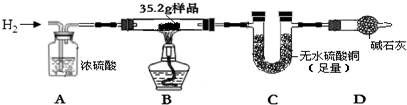
用下列装置测量烧碱样品中含碳酸钠的质量分数(提示:碱石灰成分为CaO和NaOH).请回答下列问题:
(1)装置A中氢氧化钠溶液的作用是除去空气中的二氧化碳气体;
(2)为什么先通一会儿空气后再进行装置B的化学反应,原因是将容器中的空气排干净,减小实验误差;
(3)写出装置B中化学反应产生气泡的化学方程式Na2CO3+H2SO4═Na2SO4+H2O+CO2↑,在滴加稀硫酸时,为什么要滴加到不再产生气泡为止保证将样品中的碳酸钠反应完,使测量结果更准确;
(4)本实验通过碱石灰增重测定CO2的质量,E装置的作用是吸收从装置右侧进入的空气的CO2.要称量的装置是D(填D或E或D、E).
0 150499 150507 150513 150517 150523 150525 150529 150535 150537 150543 150549 150553 150555 150559 150565 150567 150573 150577 150579 150583 150585 150589 150591 150593 150594 150595 150597 150598 150599 150601 150603 150607 150609 150613 150615 150619 150625 150627 150633 150637 150639 150643 150649 150655 150657 150663 150667 150669 150675 150679 150685 150693 211419
Ⅰ.定性探究
实验证明
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁. | 试管外壁发热 | 原因是氢氧化钠溶于水放热 |
| ②向①所得的溶液中逐滴加入过量稀硝酸 | 一开始无明显现象,一段时间后产生能使澄清石灰水变浑浊的气体. | 样品中含有的 杂质是碳酸钠. |
| ③向②所得的溶液中滴加几滴硝酸银溶液 | 产生白色沉淀 | 样品中还含有的杂 质是氯化钠 |
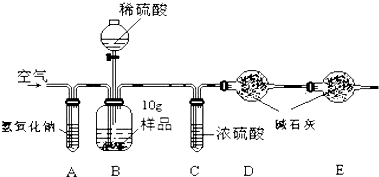
用下列装置测量烧碱样品中含碳酸钠的质量分数(提示:碱石灰成分为CaO和NaOH).请回答下列问题:

(1)装置A中氢氧化钠溶液的作用是除去空气中的二氧化碳气体;
(2)为什么先通一会儿空气后再进行装置B的化学反应,原因是将容器中的空气排干净,减小实验误差;
(3)写出装置B中化学反应产生气泡的化学方程式Na2CO3+H2SO4═Na2SO4+H2O+CO2↑,在滴加稀硫酸时,为什么要滴加到不再产生气泡为止保证将样品中的碳酸钠反应完,使测量结果更准确;
(4)本实验通过碱石灰增重测定CO2的质量,E装置的作用是吸收从装置右侧进入的空气的CO2.要称量的装置是D(填D或E或D、E).