题目内容
10.金属铝及其合金有广泛的用途(1)请描述铝元素在周期表中的位置,并画出铝的原子结构示意图;
(2)铝的化学性质活泼却耐腐蚀的原因;
(3)铝是两性金属,可以与酸反应,也可以与碱反应,与NaOH溶液反应生成NaAlO2和H2.写出反应方程式;
(4)Al在高温条件下可以与Fe3O4发生置换反应,写出方程式;
(5)工业上通过电解Al2O3冶炼铝,在负极上生成的物质是Al.
分析 (1)根据铝的原子结构分析回答;
(2)根据铝的性质分析回答;
(3)根据反应分析反应物、生成物,写出反应的化学方程式.
(4)根据反应分析反应物、生成物,写出反应的化学方程式.
(5)根据铝离子得到电子形成铝原子分析.
解答 解:(1)铝原子是13号元素,核外电子分为三个电子层,一层2个电子,二层8个电子.三层3个电子,铝元素在周期表中的位置是第三周期第ⅢA族,铝的原子结构示意图为: ;
;
(2)铝的化学性质比较活泼,易与空气中的氧气反应形成致密的氧化铝的薄膜,这是铝的化学性质活泼却耐腐蚀的原因.
(3)由题意可知,与NaOH溶液反应生成NaAlO2和H2.反应方程式是:2Al+2H2O+2NaOH=2NaAlO2+3H2↑;
(4)Al在高温条件下可以与Fe3O4发生置换反应生成了氧化铝和铁,该反应的化学方程式是:8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe.
(5)工业上通过电解Al2O3冶炼铝,铝离子得到电子形成了铝原子,所以在负极上生成的物质是Al.
故答为:(1)第三周期第ⅢA族  ;(2)铝的化学性质比较活泼,易于和空气中的氧气反应;形成一层致密的氧化铝薄膜,这层薄膜对铝有保护作用.(3)2Al+2H2O+2NaOH=2NaAlO2+3H2↑;(4)8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9 Fe;(5)Al.
;(2)铝的化学性质比较活泼,易于和空气中的氧气反应;形成一层致密的氧化铝薄膜,这层薄膜对铝有保护作用.(3)2Al+2H2O+2NaOH=2NaAlO2+3H2↑;(4)8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9 Fe;(5)Al.
点评 本题的难度不大,了解铝的性质和结构是解答本题的基础知识.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
1.氢氧化钠和氢氧化钙是两种常见的碱.李红同学将两种碱的溶液分别装人试管A、B 中,并进行了如图所示的三组实验.
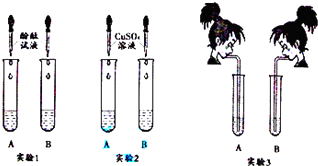
(1)实验l 中,两支试管的溶液都变成红 色.
(2)实验2中,若B 盛装的是NaOH 溶液,发生反应的化学方程式为2NaOH+CuSO4═Cu(OH)2↓+Na2SO4,该反应的基本类型是复分解 反应.
(3)实验3中,李红同学向两支试管吹气,A 中有白色沉淀生成,发生反应的化学方程式 为Ca(OH)2+CO2═CaCO3↓+H2O.B 中无现象,为了探究吹气后B 中溶质的成分,李红进行了如下探究.
提出猜想:
猜想1:溶质只有氢氧化钠
猜想2:溶质只有碳酸钠
猜想3:溶质有氢氧化钠和碳酸钠
产物中出现碳酸钠的原因:化学方程式表示2NaOH+CO2═Na2CO3+H2O
实验和结论:
反思与评价:
老师评价李红得出的结论不正确,是因为猜想2 (填数字)也会产生相同的现象.如果要验证“猜想3成立”,必须要换试剂,将Ca(OH)2换成CaCl2溶液.

(1)实验l 中,两支试管的溶液都变成红 色.
(2)实验2中,若B 盛装的是NaOH 溶液,发生反应的化学方程式为2NaOH+CuSO4═Cu(OH)2↓+Na2SO4,该反应的基本类型是复分解 反应.
(3)实验3中,李红同学向两支试管吹气,A 中有白色沉淀生成,发生反应的化学方程式 为Ca(OH)2+CO2═CaCO3↓+H2O.B 中无现象,为了探究吹气后B 中溶质的成分,李红进行了如下探究.
提出猜想:
猜想1:溶质只有氢氧化钠
猜想2:溶质只有碳酸钠
猜想3:溶质有氢氧化钠和碳酸钠
产物中出现碳酸钠的原因:化学方程式表示2NaOH+CO2═Na2CO3+H2O
实验和结论:
| 实验 | 实验现象 | 结论 |
| 取B 中少量溶液,加人澄清石灰水至不再 产生沉淀为止,过滤后取上层清液, 向其中加几滴酚酞试液. | 产生白色沉淀 溶液呈现红色 | 猜想3成立 |
老师评价李红得出的结论不正确,是因为猜想2 (填数字)也会产生相同的现象.如果要验证“猜想3成立”,必须要换试剂,将Ca(OH)2换成CaCl2溶液.
15.盐城盛产的松花蛋,又称皮蛋、变蛋.其中一种加工工艺的主要原料配方为:鸭蛋10Kg,水10Kg,生石灰1.2Kg,纯碱0.53Kg,食盐0.35Kg.加工时,将纯碱、食盐加入容器中,加沸水溶解,再慢慢加入生石灰充分反应,冷却后得到料液,再加入鸭蛋浸渍.请回答下列问题:
(1)鸭蛋中富含的营养素有水和蛋白质.
(2)生石灰加入沸水中,水能持续保持沸腾,其原因是生石灰与水反应放出大量的热.
(3)静置后,取少量的上层料液,稀释后滴加无色酚酞试液,料液应变为红色
(4)同学们对上层料液的成分产生了兴趣,请你一起参加他们的探究活动.
【提出问题】料液中含有哪些溶质?
【交流讨论】①一定含有NaOH、NaCl
②可能还含有其它溶质
甲同学推断只有Ca(OH)2
乙同学推断只有Na2CO3
丙同学推断有Ca(OH)2、也有Na2CO3
通过进一步讨论,大家一致认为丙同学的推断是错误的,理由是:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH(用化学方程式表示).
【实验探究】
【探究结论】同学的推断是正确的.
【知识应用】①皮蛋食用时加入一些食醋,可以去除氨味和涩感,原因是酸与碱发生了反应.
(1)鸭蛋中富含的营养素有水和蛋白质.
(2)生石灰加入沸水中,水能持续保持沸腾,其原因是生石灰与水反应放出大量的热.
(3)静置后,取少量的上层料液,稀释后滴加无色酚酞试液,料液应变为红色
(4)同学们对上层料液的成分产生了兴趣,请你一起参加他们的探究活动.
【提出问题】料液中含有哪些溶质?
【交流讨论】①一定含有NaOH、NaCl
②可能还含有其它溶质
甲同学推断只有Ca(OH)2
乙同学推断只有Na2CO3
丙同学推断有Ca(OH)2、也有Na2CO3
通过进一步讨论,大家一致认为丙同学的推断是错误的,理由是:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH(用化学方程式表示).
【实验探究】
| 实验步骤 | 实验现象 |
| 取少量上层料液,滴加稀盐酸 | 无明显现象 |
| 另取少量上层料液,滴加碳酸钠溶液 | 产生白色沉淀 |
【知识应用】①皮蛋食用时加入一些食醋,可以去除氨味和涩感,原因是酸与碱发生了反应.
2.有一种神奇的蜡烛,点燃后任你怎么吹也吹不灭,而且看上去和普通的蜡烛一模一样,到底是什么玄机能让蜡烛持续燃烧?请你一起参与探究.
【查阅资料】1.普通蜡烛由石蜡和蜡烛芯制成的,而吹不灭的蜡烛是在蜡烛芯上包裹一层打火石的粉末.打火石是由某种金属掺入少量稀土元素制成的合金,它的着火点只有150℃.当蜡烛燃烧时,金属并不燃烧;但当蜡烛吹灭后,未冷却的金属接触到氧气就发生燃烧,从而使蜡烛复燃.2.铝表面常有致密氧化膜,在空气中不易点燃.
【探究与反思】这种蜡烛燃烧时,蜡烛芯里的金属为什么不燃烧?蜡烛烛芯被石蜡蒸汽包围着,缺少氧气,里面的金属难以燃烧,这种蜡烛也可以熄灭,你采用的方法是隔绝氧气或剪除灯芯或用湿抹布盖灭等.
【实验探究】吹不灭的蜡烛芯内的金属可能是镁、铝、铁或铜中的一种,为确定该金属的成分,请你继续探究并完成下列有关问题:(注:不考虑打火石中稀土元素对探究金属性质的影响)
【交流反思】
(1)请写出“实验3”中可能涉及到的化学方程式Mg+CuSO4=MgSO4+Cu或2Al+3CuSO4=Al2(SO4)3+3Cu.
(2)有同学认为通过“实验3”中现象不能证明烛芯内的金属一定是镁,因为铝也能与硫酸铜溶液反应,也有红色固体析出.
(3)针对以上实验,请你设计一个合理的实验方案来进一步验证这种金属.
【查阅资料】1.普通蜡烛由石蜡和蜡烛芯制成的,而吹不灭的蜡烛是在蜡烛芯上包裹一层打火石的粉末.打火石是由某种金属掺入少量稀土元素制成的合金,它的着火点只有150℃.当蜡烛燃烧时,金属并不燃烧;但当蜡烛吹灭后,未冷却的金属接触到氧气就发生燃烧,从而使蜡烛复燃.2.铝表面常有致密氧化膜,在空气中不易点燃.
【探究与反思】这种蜡烛燃烧时,蜡烛芯里的金属为什么不燃烧?蜡烛烛芯被石蜡蒸汽包围着,缺少氧气,里面的金属难以燃烧,这种蜡烛也可以熄灭,你采用的方法是隔绝氧气或剪除灯芯或用湿抹布盖灭等.
【实验探究】吹不灭的蜡烛芯内的金属可能是镁、铝、铁或铜中的一种,为确定该金属的成分,请你继续探究并完成下列有关问题:(注:不考虑打火石中稀土元素对探究金属性质的影响)
| 实验 | 操作步骤 | 现象 | 结论 |
| 1 | 切开蜡烛,取出打火石,用砂纸打磨 | 打火石是银白色 | 该金属一定不是铜 |
| 2 | 取少量打磨后的打火石于试管中,滴加稀盐酸 | 金属溶解,有无色气体产生,溶液为无色 | 该金属一定不是铁 |
| 3 | 取少量打磨后的打火石于试管中,滴加适量硫酸铜溶液. | 有红色物质析出,溶液由蓝色变无色 | 该金属一定是镁 |
(1)请写出“实验3”中可能涉及到的化学方程式Mg+CuSO4=MgSO4+Cu或2Al+3CuSO4=Al2(SO4)3+3Cu.
(2)有同学认为通过“实验3”中现象不能证明烛芯内的金属一定是镁,因为铝也能与硫酸铜溶液反应,也有红色固体析出.
(3)针对以上实验,请你设计一个合理的实验方案来进一步验证这种金属.
| 操作步骤 | 现象 | 结论 |
| 取少量打火石打磨后加入氯化铝溶液 | 有固体析出 | 这种金属是镁 |
20.下列过程中发生化学变化的是( )
| A. | 哈气变成雾 | B. | 粮食酿酒 | C. | 冰雪融化 | D. | 酒精挥发 |