题目内容
16.兴趣小组在纯净CuO中通入一定量CO,加热,黑色固体完全变为红色.查阅资料1:Cu2O为红色固体,可发生下列反应:Cu2O+H2SO4=Cu+CuSO4+H2O
【猜测】对CO还原CuO形成的红色固体,三位同学提出如下猜想:
甲:红色固体可能是Cu; 乙:红色固体可能是Cu2O; 丙:红色固体可能是Cu和Cu2O.
【实验】
(1)取CO还原CuO后的红色固体,加入足量的稀硫酸溶液,若观察到溶液变蓝
(填实验现象),则可否认甲同学提出的猜想.
查阅资料2:加热时,H2和Cu2O能反应,产生Cu和H2O
(2)为确定CO还原CuO形成的红色固体的组成,取35.2g该红色固体样品,进行如下实验:
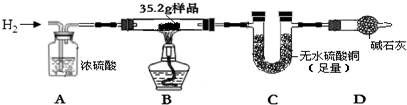
①实验时,先通一段时间的H2(填“加热样品”或“通一段时间的H2”).
②若在装置C中,观察到无水硫酸铜变蓝(填实验现象),则样品中含Cu2O.
③通入足量H2并充分加热后,测得C增加3.6g,则猜想丙(填“甲”、“乙”或“丙”)成立,写出CO还原CuO得到该固体样品的化学方程式:CO+2CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+Cu2O+CO2
【反思】取35.2g该红色固体样品,加入足量的H2SO4溶液,过滤、洗涤、干燥得到固体19.2g,则原固体中Cu的质量为6.4g,若将该样品完全氧化,则得到氧化铜的质量为24g.
分析 根据物质的颜色进行猜测,根据氧化亚铜与硫酸反应生成蓝色的硫酸铜溶液解答;根据实验装置以及题干提供的数据结合化学方程式进行计算即可.
解答 解:由于氧化亚铜是红色的,故还可以猜测是氧化亚铜,故填:Cu2O;
(2)由于稀硫酸能与氧化亚铜反应生成硫酸铜,硫酸铜的水溶液是蓝色的,故根据加入硫酸,溶液变蓝可以排除甲的猜想,故填:稀硫酸;溶液变蓝;
①氢气是具有可燃性的气体,不纯时点燃或是加热可能产生爆炸,故需要先通入氢气,故填:;
②氧化亚铜能被氢气还原生成铜和水,观察到C中无水硫酸铜变蓝,说明有水生成,证明含有氧化亚铜,故填:无水硫酸铜变蓝;
③C增重3.6g,说明生成水3.6g,其中含有的氧元素的质量为:3.6g×$\frac{16}{18}$=3.2g
故氧化亚铜的质量为:3.2g$÷\frac{16}{64×2+16}$=28.8g,而固体的质量一共是35.2g,故还有铜,因此丙同学的猜想是正确的;一氧化碳还原氧化铜生成铜、氧化亚铜和二氧化碳,故填:丙;CO+2CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+Cu2O+CO2;
【反思】根据上一题的计算可以看出,35.2g该红色固体样品中氧化亚铜的质量为28.8g,故铜的质量为:35.2g-28.8g=6.4g,若将该样品完全氧化,则得到氧化铜的质量为:19.2g$÷\frac{64}{80}$=24g,故填:6.4g;24g.
点评 本题考查的是一氧化碳还原氧化铜的知识以及剩余固体成分的实验探究,完成此题,可以依据已有的知识进行.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目
7.同学们整理实验室时,发现一瓶敞口放置且失去标签的白色粉末状药品,实验员老师告诉大家原瓶药品可能是碳酸钠、碳酸钙、氯化钠、氢氧化钠中的一种,同学们对此很好奇,于是他们对这瓶白色粉末的成分做了如下探究:
【实验Ⅰ】小明取一定量白色粉末于烧杯中,加水搅拌,充分溶解后,过滤,得到固体和无色溶液.
【实验Ⅱ】小明取实验Ⅰ得到的固体于试管中,滴加足量稀盐酸后,观察到有有气泡(现象)产生,于是小明马上就得出结论,该瓶中白色粉末一定是碳酸钙,但是小军却认为小明的结论不一定正确,固体还可能是碳酸钠,你认为小军的理由是碳酸钠的溶解度小,也会出现不溶性固体,请你写出上述有气体生成的反应的化学方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑(任写一个).
【实验Ⅲ】小明和小军认为有必要再对实验Ⅰ中滤液的成分进行探究,过程如下:
【反思与交流】实验结束后,同学们通过讨论,一致认为原试剂瓶中的药品也可能不是碳酸钠,你认为他们的理由是氢氧化钠完全变质能生成碳酸钠.
【试剂应用】某工厂化验室用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液40g,洗涤后的溶液呈中性.这一定量石油产品中含H2SO4的质量是多少?
【实验Ⅰ】小明取一定量白色粉末于烧杯中,加水搅拌,充分溶解后,过滤,得到固体和无色溶液.
【实验Ⅱ】小明取实验Ⅰ得到的固体于试管中,滴加足量稀盐酸后,观察到有有气泡(现象)产生,于是小明马上就得出结论,该瓶中白色粉末一定是碳酸钙,但是小军却认为小明的结论不一定正确,固体还可能是碳酸钠,你认为小军的理由是碳酸钠的溶解度小,也会出现不溶性固体,请你写出上述有气体生成的反应的化学方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑(任写一个).
【实验Ⅲ】小明和小军认为有必要再对实验Ⅰ中滤液的成分进行探究,过程如下:
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取少量滤液于试管中,向其滴加2滴~3滴无色酚酞试液,振荡 | 溶液由无色变为红色 | 该瓶中白色粉末一定不是碳酸钙和氯化钠 |
| (2)另取少量滤液于试管中,滴加过量氯化钙溶液,振荡,静置 | 产生白色沉淀 | 该瓶中白色粉末一定有碳酸钠,涉及的化学方程式为Na2CO3+CaCl2=2NaCl+CaCO3↓ |
【试剂应用】某工厂化验室用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液40g,洗涤后的溶液呈中性.这一定量石油产品中含H2SO4的质量是多少?
4.金属A和B的相对分子质量比为8:9,等质量的A和B分别与足量稀盐酸反应,生成的氢气质量比为3:4.则两金属的化合价之比为( )
| A. | 2:3 | B. | 3:2 | C. | 2:1 | D. | 1:2 |
11.某研究性学习小组对“氯碱工业”生产的烧碱样品(可能含有碳酸钠、氯化钠等杂质)进行如下探究.
Ⅰ.定性探究
实验证明
Ⅱ.定量探究:
用下列装置测量烧碱样品中含碳酸钠的质量分数(提示:碱石灰成分为CaO和NaOH).请回答下列问题:
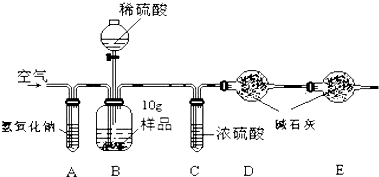
(1)装置A中氢氧化钠溶液的作用是除去空气中的二氧化碳气体;
(2)为什么先通一会儿空气后再进行装置B的化学反应,原因是将容器中的空气排干净,减小实验误差;
(3)写出装置B中化学反应产生气泡的化学方程式Na2CO3+H2SO4═Na2SO4+H2O+CO2↑,在滴加稀硫酸时,为什么要滴加到不再产生气泡为止保证将样品中的碳酸钠反应完,使测量结果更准确;
(4)本实验通过碱石灰增重测定CO2的质量,E装置的作用是吸收从装置右侧进入的空气的CO2.要称量的装置是D(填D或E或D、E).
Ⅰ.定性探究
实验证明
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁. | 试管外壁发热 | 原因是氢氧化钠溶于水放热 |
| ②向①所得的溶液中逐滴加入过量稀硝酸 | 一开始无明显现象,一段时间后产生能使澄清石灰水变浑浊的气体. | 样品中含有的 杂质是碳酸钠. |
| ③向②所得的溶液中滴加几滴硝酸银溶液 | 产生白色沉淀 | 样品中还含有的杂 质是氯化钠 |
用下列装置测量烧碱样品中含碳酸钠的质量分数(提示:碱石灰成分为CaO和NaOH).请回答下列问题:

(1)装置A中氢氧化钠溶液的作用是除去空气中的二氧化碳气体;
(2)为什么先通一会儿空气后再进行装置B的化学反应,原因是将容器中的空气排干净,减小实验误差;
(3)写出装置B中化学反应产生气泡的化学方程式Na2CO3+H2SO4═Na2SO4+H2O+CO2↑,在滴加稀硫酸时,为什么要滴加到不再产生气泡为止保证将样品中的碳酸钠反应完,使测量结果更准确;
(4)本实验通过碱石灰增重测定CO2的质量,E装置的作用是吸收从装置右侧进入的空气的CO2.要称量的装置是D(填D或E或D、E).

