5.体操运动员在完成单杠、吊环项目时常用“镁粉”搓手,以起到防滑效果.某种“镁粉”中可能含有Mg、MgO、Mg(OH)2、MgCO3中的一种或两种固体,实验小组对其成分展开了探究.
已知:MgO+2HCl=MgCl2+H2O
MgCO3+2HCl=MgCl2+H2O+CO2↑
(1)探究“镁粉”中是否含有Mg和MgCO3
(2)①取少量样品,如图1所示进行实验.观察到a试管中有气泡产生,b试管中产生的现象是澄清石灰水变浑浊,则证明“镁粉”中一定含有MgCO3.
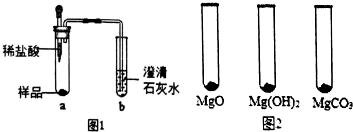
②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭.但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成浓NaOH溶液,目的是把二氧化碳全部吸收.小明按照修改后的实验方案重复上述实验,观察到b试管口无明显现象,证明“镁粉”中没有Mg.
(3)探究“镁粉”中是否还含有MgO及Mg(OH)2
【实验过程】
Ⅰ.用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验.分别取0.5g三种固体粉末,每次取样方法如图2所示:
逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失.在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
Mg(OH)2与盐酸发生中和反应的化学方程式为Mg(OH)2+2HCl=MgCl2+2H2O.
Ⅱ.取“镁粉”样品0.5g,加入上述稀盐酸至粉末恰好溶解.此时消耗稀盐酸的体积约为5.3mL.
【实验分析及结论】
“镁粉”不只含有MgCO3.理由是0.5g“镁粉”消耗稀盐酸的体积与0.5gMgCO3消耗稀盐酸的体积不相等.
【实验反思】
为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5g“镁粉”和0.5gMgCO3,加入足量稀盐酸,测定生成的气体体积分别为119mL和140mL.由此可知“镁粉”中含有MgCO3的质量分数为85%.
已知:MgO+2HCl=MgCl2+H2O
MgCO3+2HCl=MgCl2+H2O+CO2↑
(1)探究“镁粉”中是否含有Mg和MgCO3
(2)①取少量样品,如图1所示进行实验.观察到a试管中有气泡产生,b试管中产生的现象是澄清石灰水变浑浊,则证明“镁粉”中一定含有MgCO3.

②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭.但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成浓NaOH溶液,目的是把二氧化碳全部吸收.小明按照修改后的实验方案重复上述实验,观察到b试管口无明显现象,证明“镁粉”中没有Mg.
(3)探究“镁粉”中是否还含有MgO及Mg(OH)2
【实验过程】
Ⅰ.用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验.分别取0.5g三种固体粉末,每次取样方法如图2所示:
逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失.在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
| MgO | Mg(OH)2 | MgCO3 | |
| 消耗稀盐酸的体积/mL | 10.4 | 7.2 | 5.0 |
Ⅱ.取“镁粉”样品0.5g,加入上述稀盐酸至粉末恰好溶解.此时消耗稀盐酸的体积约为5.3mL.
【实验分析及结论】
“镁粉”不只含有MgCO3.理由是0.5g“镁粉”消耗稀盐酸的体积与0.5gMgCO3消耗稀盐酸的体积不相等.
【实验反思】
为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5g“镁粉”和0.5gMgCO3,加入足量稀盐酸,测定生成的气体体积分别为119mL和140mL.由此可知“镁粉”中含有MgCO3的质量分数为85%.
3.金属及合金是重要的工业级建筑材料,某些金属离子是人体不可或缺的元素.
(1)如表是A、B、C三种金属的部分物理性质.
①三种金属中最不适宜作导线的是C(填字母),高压输电线不用金属A而选用金属B,主要原因是金属B的密度小.
②C的合金通常可以做菜刀、锤子等,其合金的硬度>5(填“>”“<”或“=”).
(2)某化学小组的同学在老师的指导下对黄铜中锌、铜含量的测定展开了探究.
【提出问题】测定黄铜中锌、铜的质量分数.
【探究过程】

【交流讨论】①探究过程中发生反应的化学方程式是Zn+2HCl═ZnCl2+H2↑;
②图示中“操作”正确的顺序是:过滤、洗涤、烘干.
③配制上属于实验所需的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是40g;
【实验结论】黄铜中锌的质量分数为13%.
【拓展延伸】要验证银、铁、铜的活动性顺序,晓飞同学已经选择了打磨过的铜丝和硝酸银溶液,你认为他还需要的一种溶液是硫酸亚铁溶液.
(1)如表是A、B、C三种金属的部分物理性质.
| 性质 金属 | 导电性(100为标准) | 密度(g/cm3) | 熔点(℃) | 硬度(10为标准) |
| A | 99 | 8.92 | 1083 | 3 |
| B | 61 | 2.70 | 660 | 2.9 |
| C | 17 | 7.86 | 1535 | 5 |
②C的合金通常可以做菜刀、锤子等,其合金的硬度>5(填“>”“<”或“=”).
(2)某化学小组的同学在老师的指导下对黄铜中锌、铜含量的测定展开了探究.
【提出问题】测定黄铜中锌、铜的质量分数.
【探究过程】

【交流讨论】①探究过程中发生反应的化学方程式是Zn+2HCl═ZnCl2+H2↑;
②图示中“操作”正确的顺序是:过滤、洗涤、烘干.
③配制上属于实验所需的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是40g;
【实验结论】黄铜中锌的质量分数为13%.
【拓展延伸】要验证银、铁、铜的活动性顺序,晓飞同学已经选择了打磨过的铜丝和硝酸银溶液,你认为他还需要的一种溶液是硫酸亚铁溶液.
2.工业上用电解饱和食盐水的方法生产烧碱、氢气、氯气等化工产品,其反应原理为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
【提出问题】烧碱样品中可能含有哪些杂质?
【猜想】
猜想一:可能含有碳酸钠,猜想的依据是2NaOH+CO2=Na2CO3+H2O(用化学方程式表示);
猜想二:可能含有NaCl,猜想的依据是在化工生产中,原料往往不能完全转化为产品.
【实验探究】请帮甲同学完成以下探究实验:
乙同学为了验证猜想一的实验结论,也向烧碱样品的溶液中滴加了少量稀硝酸,却发现无气泡产生.
【解释与结论】大家经过分析,发现乙同学所用试剂与甲同学相同,却没有看到气泡,原因可能是少量的稀硝酸先与样品中的氢氧化钠反应完.
【交流与反思】丙同学提出:“在甲同学做的实验中,稀硝酸也可以用稀盐酸代替.”你认为他的观点不正确(填“正确”或“不正确”).
0 150476 150484 150490 150494 150500 150502 150506 150512 150514 150520 150526 150530 150532 150536 150542 150544 150550 150554 150556 150560 150562 150566 150568 150570 150571 150572 150574 150575 150576 150578 150580 150584 150586 150590 150592 150596 150602 150604 150610 150614 150616 150620 150626 150632 150634 150640 150644 150646 150652 150656 150662 150670 211419
【提出问题】烧碱样品中可能含有哪些杂质?
【猜想】
猜想一:可能含有碳酸钠,猜想的依据是2NaOH+CO2=Na2CO3+H2O(用化学方程式表示);
猜想二:可能含有NaCl,猜想的依据是在化工生产中,原料往往不能完全转化为产品.
【实验探究】请帮甲同学完成以下探究实验:
| 猜想 | 实验步骤 | 实验现象 | 实验结论 |
| 猜想一 | ①取少量烧碱样品于试管中,加水溶解,向其中滴加过量稀硝酸 | 有气泡产生 | 样品中含有碳酸钠或样品中含有Na2CO3 |
| ②将步骤①中产生的气体通入澄清的石灰水中 | 澄清石灰水变浑浊 | ||
| 猜想二 | ③向步骤①所得的溶液中滴加几滴AgNO3溶液 | 产生白色沉淀 | 样品中含有氯化钠 |
【解释与结论】大家经过分析,发现乙同学所用试剂与甲同学相同,却没有看到气泡,原因可能是少量的稀硝酸先与样品中的氢氧化钠反应完.
【交流与反思】丙同学提出:“在甲同学做的实验中,稀硝酸也可以用稀盐酸代替.”你认为他的观点不正确(填“正确”或“不正确”).



 实验室常用于制取氧气的方法有:a加热氯酸钾晶体和二氧化锰粉末;b加热高锰酸钾固体;c用二氧化锰粉末作催化剂使过氧化氢(H2O2)溶液分解产生水和氧气.
实验室常用于制取氧气的方法有:a加热氯酸钾晶体和二氧化锰粉末;b加热高锰酸钾固体;c用二氧化锰粉末作催化剂使过氧化氢(H2O2)溶液分解产生水和氧气. 空气中含量最多的气体是氮气;石灰水露置在空气中一段时间后,液面会形成一层白色薄膜,原因是空气中含有二氧化碳;松脆的饼干放在空气中两三天就变软了,证明了空气中含有水.如图用红磷燃烧来测定空气中氧气的含量,所发生反应的文字表达式为磷+氧气$\frac{点燃}{\;}$五氧化二磷.(本题填写出正确的化学式也给分)
空气中含量最多的气体是氮气;石灰水露置在空气中一段时间后,液面会形成一层白色薄膜,原因是空气中含有二氧化碳;松脆的饼干放在空气中两三天就变软了,证明了空气中含有水.如图用红磷燃烧来测定空气中氧气的含量,所发生反应的文字表达式为磷+氧气$\frac{点燃}{\;}$五氧化二磷.(本题填写出正确的化学式也给分)