18.工业上常利用电石制乙炔气体(C2H2)时产生的灰浆和残渣制备化工原料KClO3和超细CaCO3.
电石制乙炔气体(C2H2)时产生灰浆和残渣的过程如下:电石(CaC2)$\stackrel{水}{→}$灰浆$\stackrel{露置于空气}{→}$残渣
其中电石与水反应生成氢氧化钙和乙炔,该反应的化学方程式为:CaC2+2H2O═Ca(OH)2+C2H2↑
残渣中主要成分是Ca(OH)2和CaCO3.
Ⅰ.制备KClO3的流程如图1所示:
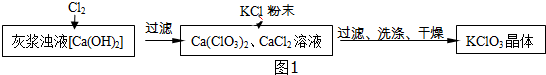
(1)向灰浆浊液中通入Cl2,得到Ca(ClO3)2、CaCl2溶液.反应中Ca(ClO3)2与CaCl2的化学计量数分别为1和5.写出此反应的化学方程式6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O.
(2)有关物质在常温下的溶解度如表:
上述流程中加入KCl粉末,KCl与Ca(ClO3)2(填化学式)发生了复分解反应,得到KClO3晶体.你认为能得到KClO3 晶体的原因是相同温度下,氯酸钾的溶解度小.
(3)洗涤时,可以选用下列BC作洗涤剂(填字母编号).
A.KCl饱和溶液 B.冰水 C.饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如图2所示(注:加入NH4Cl溶液的目的是溶解残渣中的难溶盐):
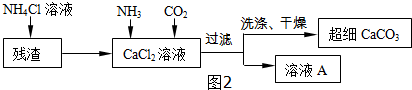
(4)流程中溶液A可循环使用,其主要成分的化学式是NH4Cl.
电石制乙炔气体(C2H2)时产生灰浆和残渣的过程如下:电石(CaC2)$\stackrel{水}{→}$灰浆$\stackrel{露置于空气}{→}$残渣
其中电石与水反应生成氢氧化钙和乙炔,该反应的化学方程式为:CaC2+2H2O═Ca(OH)2+C2H2↑
残渣中主要成分是Ca(OH)2和CaCO3.
Ⅰ.制备KClO3的流程如图1所示:

(1)向灰浆浊液中通入Cl2,得到Ca(ClO3)2、CaCl2溶液.反应中Ca(ClO3)2与CaCl2的化学计量数分别为1和5.写出此反应的化学方程式6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O.
(2)有关物质在常温下的溶解度如表:
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
(3)洗涤时,可以选用下列BC作洗涤剂(填字母编号).
A.KCl饱和溶液 B.冰水 C.饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如图2所示(注:加入NH4Cl溶液的目的是溶解残渣中的难溶盐):

(4)流程中溶液A可循环使用,其主要成分的化学式是NH4Cl.
14.学习化学的目的,不在于要成为化学家,重要的是要善于用化学知识去分析、解决生产、生活中的问题.从化学角度看,下列说法中错误的是( )
| A. | 发现燃气(天然气、煤气或液化石油气等)泄漏,点火检查出泄漏处 | |
| B. | 进入小煤窑严禁吸烟 | |
| C. | 炒菜时油锅着火,可用锅盖盖灭火焰 | |
| D. | 面料厂、加油站严禁烟火 |
13.常温常压下,10mL某气态物质含有2.68×1020个原子,则判断该物质是一种( )
| A. | 单质 | B. | 化合物 | ||
| C. | 混合物 | D. | 以上选项都有可能 |
10.下列实验方案中,不合理的是( )
0 149703 149711 149717 149721 149727 149729 149733 149739 149741 149747 149753 149757 149759 149763 149769 149771 149777 149781 149783 149787 149789 149793 149795 149797 149798 149799 149801 149802 149803 149805 149807 149811 149813 149817 149819 149823 149829 149831 149837 149841 149843 149847 149853 149859 149861 149867 149871 149873 149879 149883 149889 149897 211419
| A. | 用CO2来区分两种无色液体:水和石灰水 | |
| B. | 用点燃的方法除去CO2中混有少量CO | |
| C. | 用灼烧的方法区分两种黑色粉末:木炭粉和氧化铜 | |
| D. | 用过滤的方法除去NaCl溶液中混有的少量大理石 |




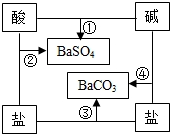 如图是常见酸、碱、盐之间的相互转化关系.
如图是常见酸、碱、盐之间的相互转化关系.
