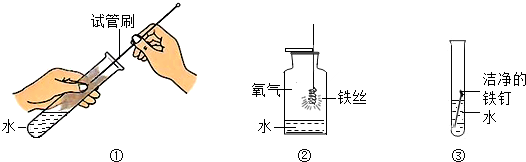
11.下列实验操作错误的是( )
| A. |  | B. |  | C. |  | D. |  |
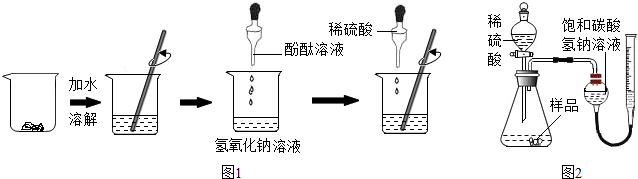
10.量取一定量的液体药品,常用( )
| A. | 量筒和胶头滴管 | B. | 细口瓶 | C. | 试管 | D. | 玻璃管 |
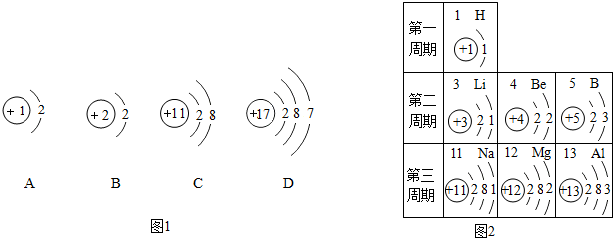
9.下列变化中,属于化学变化的是( )
0 149696 149704 149710 149714 149720 149722 149726 149732 149734 149740 149746 149750 149752 149756 149762 149764 149770 149774 149776 149780 149782 149786 149788 149790 149791 149792 149794 149795 149796 149798 149800 149804 149806 149810 149812 149816 149822 149824 149830 149834 149836 149840 149846 149852 149854 149860 149864 149866 149872 149876 149882 149890 211419
| A. | 红磷燃烧 | B. | 冰融化成水 | C. | 矿石粉碎 | D. | 酒精挥发 |
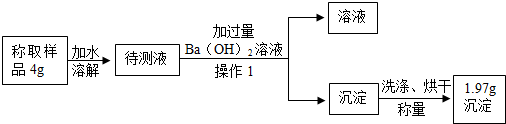
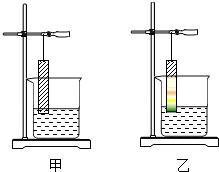 菠菜是一种营养价值很高的蔬菜.小明同学为了研究菠菜汁的成份,进行如下实验:
菠菜是一种营养价值很高的蔬菜.小明同学为了研究菠菜汁的成份,进行如下实验: A-H都是初中化学中常见的物质,已知A、B为黑色固体,C为气体,D为红色固体单质,F为红色固体化合物,它们的转化关系如图所示.请回答:
A-H都是初中化学中常见的物质,已知A、B为黑色固体,C为气体,D为红色固体单质,F为红色固体化合物,它们的转化关系如图所示.请回答: