12. 同学们想测定一定质量的石灰石中CaCO3质量分数,他们设计了如图的实验装置(碱石灰的成分是CaO和NaOH的混合物),利用测定碱石灰质量增加来计算碳酸钙的质量.
同学们想测定一定质量的石灰石中CaCO3质量分数,他们设计了如图的实验装置(碱石灰的成分是CaO和NaOH的混合物),利用测定碱石灰质量增加来计算碳酸钙的质量.
(1)该装置导致实验结果偏大的可能原因是BCD.
A.装置内残留的CO2气体不能全部排出.
B.产生的CO2气体中混有氯化氢气体,同时被碱石灰吸收.
C.产生的CO2气体中混有水蒸气,同时被碱石灰吸收.
D.球形干燥管与空气相通,也会吸收空气中的CO2和H2O.
(2)做完上述实验后,同学们对反应后反应器内的剩余溶液的溶质成分产生了兴趣,他们继续进行了以下实验探究:将剩余的溶液倒入烧杯中,微热后冷却到室温.
上表甲、乙、丙三个同学的实验操作中有错误的是丙(选填“甲”“乙”或“丙”)同学的方案.
 同学们想测定一定质量的石灰石中CaCO3质量分数,他们设计了如图的实验装置(碱石灰的成分是CaO和NaOH的混合物),利用测定碱石灰质量增加来计算碳酸钙的质量.
同学们想测定一定质量的石灰石中CaCO3质量分数,他们设计了如图的实验装置(碱石灰的成分是CaO和NaOH的混合物),利用测定碱石灰质量增加来计算碳酸钙的质量.(1)该装置导致实验结果偏大的可能原因是BCD.
A.装置内残留的CO2气体不能全部排出.
B.产生的CO2气体中混有氯化氢气体,同时被碱石灰吸收.
C.产生的CO2气体中混有水蒸气,同时被碱石灰吸收.
D.球形干燥管与空气相通,也会吸收空气中的CO2和H2O.
(2)做完上述实验后,同学们对反应后反应器内的剩余溶液的溶质成分产生了兴趣,他们继续进行了以下实验探究:将剩余的溶液倒入烧杯中,微热后冷却到室温.
| 实验操作 | 实验现象 | 实验结论 | |
甲同学 | 取烧杯中溶液少许于试管中,向其中滴加紫色石蕊试液 | 现象:溶液变为红色 | 溶液显酸性(含有H+);溶质中有氯化氢. |
乙同学 | 取烧杯中溶液少许于试管中,向其中加入少量锌粒 | 现象:产生气泡,反应的化学方程式是: Zn+2HCl═ZnCl2+H2↑ | |
丙同学 | 取烧杯中溶液少许于试管中,向其中加入少量硝酸银溶液 | 现象:产生白色沉淀 |
11.已知磷酸二氢铵(NH4H2PO4)是一种常用的化肥,下列说法错误的是( )
| A. | 磷酸二氢铵是一种复合肥料 | |
| B. | 磷酸二氢铵是由氮、氢、磷、氧四种元素组成 | |
| C. | 磷酸二氢铵属于盐类化合物 | |
| D. | 磷酸二氢铵中,氮、氢、磷、氧元素的质量比是1:6:1:4 |
10.下列属于化学变化的是( )
| A. | 玻璃碎了 | B. | 干冰升华 | C. | 蜡烛燃烧 | D. | 泥土飞扬 |
9.坚持绿色发展,构建生态盐城,下列做法不符合这一宗旨的是( )
| A. | 鼓励植树造林,打造绿色家园 | B. | 增加燃煤发电,保障电力供应 | ||
| C. | 禁止燃放烟花,减轻雾霾影响 | D. | 发展公共交通,提倡低碳生活 |
8.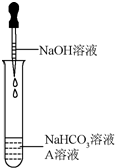 同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.
同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.
(1)实验装备
①查阅资料:NaHCO3+NaOH═Na2CO3+H2O
②用一定溶质的质量分数的NaHCO3、NaOH和Na2CO3三种溶液进行如下实验,为设计实验方案提供参考.
表中的现象Ⅰ为有气泡产生,现象Ⅱ对应反应的化学方程式为Ca(OH)2+Na2CO3=2NaOH+CaCO3↓.
(2)实验过程
【实验1】证明反应生成了Na2CO3
同学们选用上表实验中的药品,设计了如右图所示实验,先在NaHCO3溶液中加入A溶液,无明显现象,再滴加NaOH溶液,溶液变浑浊,则A溶液是CaCl2溶液.
有同学提出这个实验不足以证明有Na2CO3生成,其理由是CaCl2 和NaOH反应生成Ca(OH)2,氢氧化钙是微溶物,在溶液中也产生沉淀.为了证明有Na2CO3生成,需要继续进行的操作是取少量反应后滤渣加入足量的稀盐酸,若产生无色气体证明有Na2CO3生成,反之则没有.
【实验2】证明反应后NaHCO3不存在
同学们参考上表中的实验,又设计了一个实验,虽然没有观察到明显的实验现象,但可以证明反应发生了,该实验方案是取少量反应后的溶液加热至沸腾,将气体通入澄清石灰水,若澄清石灰水变浑浊,证明有:NaHCO3存在,反之则没有.
 同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.
同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.(1)实验装备
①查阅资料:NaHCO3+NaOH═Na2CO3+H2O
②用一定溶质的质量分数的NaHCO3、NaOH和Na2CO3三种溶液进行如下实验,为设计实验方案提供参考.
| NaHCO3溶液 | NaOH溶液 | Na2CO3溶液 | |
| 加入稀盐酸 | 现象Ⅰ | 无明显变化 | 产生气泡 |
| 加入澄清石灰水 | 溶液变浑浊 | 无明显变化 | 现象Ⅱ |
| 加入CaCl2溶液 | 无明显变化 | 溶液变浑浊 | 溶液变浑浊 |
| 加热溶液至沸腾,将 气体通入澄清石灰水 | 澄清石灰水 变浑浊 | 澄清石灰水 无明显变化 | 澄清石灰水 无明显变化 |
(2)实验过程
【实验1】证明反应生成了Na2CO3
同学们选用上表实验中的药品,设计了如右图所示实验,先在NaHCO3溶液中加入A溶液,无明显现象,再滴加NaOH溶液,溶液变浑浊,则A溶液是CaCl2溶液.
有同学提出这个实验不足以证明有Na2CO3生成,其理由是CaCl2 和NaOH反应生成Ca(OH)2,氢氧化钙是微溶物,在溶液中也产生沉淀.为了证明有Na2CO3生成,需要继续进行的操作是取少量反应后滤渣加入足量的稀盐酸,若产生无色气体证明有Na2CO3生成,反之则没有.
【实验2】证明反应后NaHCO3不存在
同学们参考上表中的实验,又设计了一个实验,虽然没有观察到明显的实验现象,但可以证明反应发生了,该实验方案是取少量反应后的溶液加热至沸腾,将气体通入澄清石灰水,若澄清石灰水变浑浊,证明有:NaHCO3存在,反之则没有.
7.下列问题的研究中,未利用对比实验思想方法的是( )
| A. |  MnO2的催化作用 | B. |  碘的溶解性 | ||
| C. |  白磷红磷着火点 | D. |  水的组成 |
4.如图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法错误的是( )

0 147372 147380 147386 147390 147396 147398 147402 147408 147410 147416 147422 147426 147428 147432 147438 147440 147446 147450 147452 147456 147458 147462 147464 147466 147467 147468 147470 147471 147472 147474 147476 147480 147482 147486 147488 147492 147498 147500 147506 147510 147512 147516 147522 147528 147530 147536 147540 147542 147548 147552 147558 147566 211419

| A. | 乙的饱和溶液由t2℃降温到t1℃时,溶质的质量分数不变 | |
| B. | 甲中含有少量乙,可以用冷却热饱和溶液结晶的方法提纯甲 | |
| C. | t1℃时,50g水中分别加入10g的甲、乙,可得到甲、乙的饱和溶液 | |
| D. | t1℃时,等质量甲、乙两物质的溶液蒸发等质量的水,析出晶体质量相等 |

 某校综合实践活动小组在进行”诚信商品”研究时,检验商品标签所列成分及含量与事实是否相符,随机取出市售某纯碱样品(成分说明见图).经检验杂质仅是氯化钠.准确称取样品10.9克,加入50克氯化钙溶液使其充分反应(纯碱指碳酸钠),将反应生成的沉淀物经过滤,洗涤,干燥后得到白色固体10克.
某校综合实践活动小组在进行”诚信商品”研究时,检验商品标签所列成分及含量与事实是否相符,随机取出市售某纯碱样品(成分说明见图).经检验杂质仅是氯化钠.准确称取样品10.9克,加入50克氯化钙溶液使其充分反应(纯碱指碳酸钠),将反应生成的沉淀物经过滤,洗涤,干燥后得到白色固体10克.