为测定某氨肥中硫酸铵的纯度(即质量分数)是否与如图标签相符,小林取一定量该氨肥样品与烧杯中配成溶液与足量氯化钡溶液反应,记录有关数据如下表
| 反应前 | 反应后 |
|
| 烧杯和样品溶液总质量 | 氯化钡溶液质量 | 过滤后烧杯和溶液总质量(滤液的损失忽略不计) |
| 45g | 55g | 76.7g |
【反应的化学方程式为(NH4)2SO4+BaCl2═BaSO4↓+2NH4Cl4,其他成分能溶于水但不参加反应】
(1)反应共生成BaSO4的质量为 g
(2)若所取氨肥样品的质量为15g,试通过计算确定氨肥中硫酸铵的纯度是否与标签相符.(请写出计算过程)
(3)反应前后,溶液中硫元素的质量 (填“不变”、“增大”或“减小”)

现有10.6g碳酸钠和8.4g碳酸氢钠,分别与过量盐酸反应,其中( )
|
| A. | 碳酸钠消耗的氯化氢多 | B. | 碳酸氢钠生成的二氧化碳多 |
|
| C. | 碳酸氢钠消耗的氯化氢多 | D. | 碳酸氢钠生成的二氧化碳多 |
把盛有5g 16%的NaOH溶液的短试管放入盛有10g 16%的CuSO4溶液的锥形瓶里,如图所示,倾斜锥形瓶直到使两溶液充分混合,混合后不可能的是( )
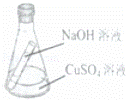
|
| A. | 产生蓝色沉淀0.98g |
|
| B. | 锥形瓶内物质总质量不变 |
|
| C. | 所得溶液的Na2SO4质量分数大于9.5% |
|
| D. | 所得的Na2SO4溶液质量与原CuSO4溶液质量相等 |
烧杯中有一定质量的MgO和MgCO3的混合物,向其中加入150g稀盐酸,恰好完全反应,一定温度下,得到156g不饱和溶液.下列数据中,与该溶液的溶质质量分数最接近的是( )
|
| A. | 16.6% | B. | 6.1% | C. | 12.2% | D. | 9.1% |
六硅酸镁可表示为aMgO•6SiO2•bH2O.确定六硅酸镁组成的方法是:取10.6g六硅酸镁,充分加热失水后,得固体8.8g;另取相同质量的六硅酸镁加入足量盐酸,充分反应后,经处理得SiO2固体7.2g,下列说法正确的是( )
|
| A. | a=2 | B. | a=3 | C. | b=5 | D. | b=7 |
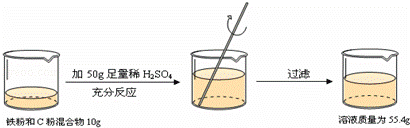
根据下面的实验过程和提供的数据,可知样品中碳的质量分数为( )
|
| A. | 44% | B. | 46% | C. | 54% | D. | 64% |
将一定质量的铁和氧化铜的混合物粉末放入足量稀盐酸中,充分反应后产生气体0.4g,并得到残留固体6.4g.则原混合物粉末的质量是( )
|
| A. | 8.0g | B. | 11.2g | C. | 16.0g | D. | 24.8g |