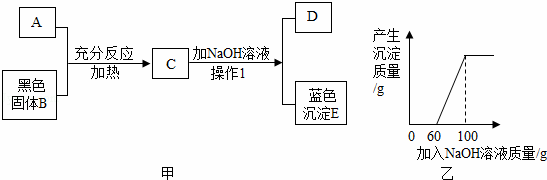
题目内容
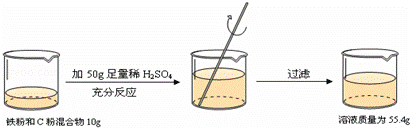
根据下面的实验过程和提供的数据,可知样品中碳的质量分数为( )
|
| A. | 44% | B. | 46% | C. | 54% | D. | 64% |
考点:
根据化学反应方程式的计算.
专题:
有关化学方程式的计算.
分析:
根据图中所给的数据结合质量守恒定律可以求出原混合物中碳的质量与生成的氢气质量和;设碳的质量为x,则铁的质量为10g﹣x,用含x的式子表示出生成的氢气的质量,再根据碳的质量与生成的氢气质量和,求出X的质量,最后求出碳的质量分数.
解答:
解:设碳的质量为x,则铁的质量为10g﹣x,生产的氢气的质量为a,
Fe+H2SO4=FeSO4+H2↑
56 2
x a
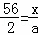 解得:a=
解得:a= ,
,
x+ =50g+10g﹣55.4g
=50g+10g﹣55.4g
解得:x≈4.4g
样品中碳的质量分数为: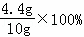 =44%
=44%
由以上计算可知.A正确.
故选A.
点评:
本题中考查的知识点较多,主要是依据化学方程式进行计算,在解答时要注意运用质量守恒定律来得出计算所必须的已知量,然后依据化学方程式进行计算,同时要学会求算物质中元素的质量.

练习册系列答案
相关题目
下列鉴别两种不同物质的方法,不正确的是( )
| 序号 | 待鉴别的物质 | 鉴别方法 |
| A | CO2与O2 | 燃着的木条,观察燃烧情况 |
| B | 酒精与白醋 | 闻气味 |
| C | BaCO3与NaCl | 加水,观察是否溶解 |
| D | NaOH与Na2CO3 | 滴加酚酞溶液, |
| 观察溶液颜色的变化 |

 饱和溶液能用降温的方法转化为不饱和溶液
饱和溶液能用降温的方法转化为不饱和溶液
 一种常见的酸,且只含有两种元素;C是一种钠盐。它们相互间转化或发生反应的关系如图所示。(“-”表示两种物质间能发生化学反应,“→”表
一种常见的酸,且只含有两种元素;C是一种钠盐。它们相互间转化或发生反应的关系如图所示。(“-”表示两种物质间能发生化学反应,“→”表 示两种物质间的转化关系。)
示两种物质间的转化关系。)