题目内容
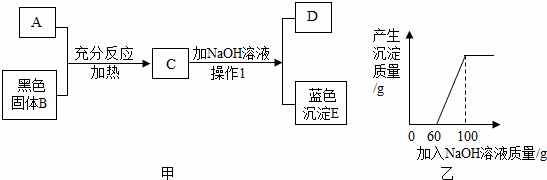
图甲中A是一种常见的酸,它能与黑色固体B反应,B质量为8克,将NaOH溶液渐渐加入到C中,生成蓝色沉淀E的质量与加入NaOH溶液的质量关系如图乙所示,在D中加入Ba(NO3)2溶液能生成一种不溶于稀硝酸的白色沉淀.
(1)A溶液中溶质的化学式为 ;
(2)操作1的名称是 ;
(3)NaOH溶液中溶质的质量分数是多少?
(4)C溶液中加入NaOH溶液至恰好完全反应时,所得溶液溶质的质量是多少?
考点:
根据化学反应方程式的计算;有关溶质质量分数的简单计算;物质的鉴别、推断.
专题:
综合计算(图像型、表格型、情景型计算题).
分析:
(1)根据物质间反应的规律以及物质的颜色,来确定物质的名称;
(2)操作1是分离硫酸钠溶液和氢氧化铜蓝色沉淀的一种方法;
(3)根据氧化铜的质量计算出硫酸铜的质量,然后根据硫酸铜的质量计算出与之反应所需氢氧化钠的质量,而由图象可知与硫酸铜反应的氢氧化钠溶液的质量为(100g﹣60g),最后计算出氢氧化钠溶液中溶质的质量分数;
(4)由图象可知,C溶液中的溶质为硫酸和硫酸铜,加入的氢氧化钠与二者均反应,利用化学方程式分别计算出硫酸钠的质量即可.
解答:
解:(1)在D中加入Ba(NO3)2溶液能生成一种不溶于稀硝酸的白色沉淀,所以D溶液中一定存在硫酸根离子,E是蓝色沉淀,则是氢氧化铜,那么C是硫酸铜,D是硫酸钠;黑色固体为氧化铜,酸为稀硫酸,故填:H2SO4;
(2)操作1是分离难溶性固体和液体的一种方法,是过滤;故填:过滤;
(3)解:设由CuO生成的CuSO4的质量为x
CuO+H2SO4=CuSO4+H2O
80 160
8g x
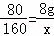
x=16g
设与CuSO4反应的NaOH的质量为y,同时生成Na2SO4的质量为a
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
160 80 142
16g y a

y=8g
所用氢氧化钠溶液中溶质的质量分数为: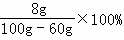 =20%
=20%

a=14.2g
答:NaOH溶液中溶质的质量分数是20%.
(4)解:设与H2SO4反应的NaOH的质量为b
H2SO4+2NaOH=Na2SO4+2H2O
80 142
60g×20% b
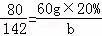
b=21.3g
所得溶液中溶质的质量为:21.3g+14.2g=35.5g
答:C溶液中加入NaOH溶液至恰好完全反应时,所得溶液溶质的质量是35.5g.
点评:
本考点考查了根据化学方程式的计算和质量分数的计算,是考试计算题中经常出现的题型.做题时要注意:化学方程式要写正确,始终不要忘记质量守恒定律.

 优加精卷系列答案
优加精卷系列答案根据下面的实验过程和提供的数据,可知样品中碳的质量分数为( )
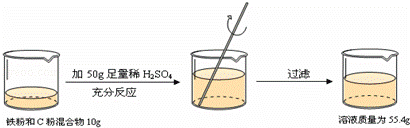
|
| A. | 44% | B. | 46% | C. | 54% | D. | 64% |
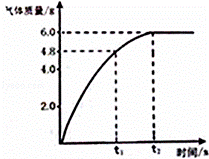
 表示向一定体积的稀盐酸中逐滴加入氢氧化钠溶液
表示向一定体积的稀盐酸中逐滴加入氢氧化钠溶液
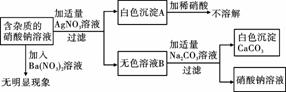
 化钠溶液
化钠溶液