题目内容
将一定质量的铁和氧化铜的混合物粉末放入足量稀盐酸中,充分反应后产生气体0.4g,并得到残留固体6.4g.则原混合物粉末的质量是( )
|
| A. | 8.0g | B. | 11.2g | C. | 16.0g | D. | 24.8g |
考点:
根据化学反应方程式的计算.
专题:
有关化学方程式的计算.
分析:
将一定质量的铁和氧化铜的混合物粉末放入足量稀盐酸中,铁能与稀盐酸反应,氧化铜能与稀盐酸反应生成了氯化铜和水,铁能与氯化铜反应生成铜和氯化亚铁.根据生成氢气的质量求出与稀盐酸反应的铁的质量,根据生成铜的质量可求出与氯化铜反应的铁的质量,还可求出氧化铜的质量,将三者加在一起就是原混合物的质量.
解答:
解:由题意可知,将一定质量的铁和氧化铜的混合物粉末放入足量稀盐酸中,铁能与稀盐酸反应生成氯化亚铁和氢气,氧化铜能与稀盐酸反应生成了氯化铜和水,铁能与氯化铜反应生成铜和氯化亚铁.
设与稀盐酸反应的铁的质量为x
Fe+2HCl═FeCl2+H2↑
56 2
x 0.4g
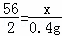 解得:x=11.2g
解得:x=11.2g
设与氯化铜反应的铁的质量为y
Fe+CuCl2═FeCl2+Cu
56 64
y 6.4g
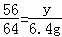 解得:y=5.6g
解得:y=5.6g
氧化铜的质量为:6.4g÷(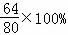 )=8.0g
)=8.0g
所以,原混合物的质量为:11.2g+5.6g+8.0g=24.8g
由以上计算分析可知,D正确.
故选D.
点评:
本题主要考查了根据化学方程式的计算.解答本题的关键是分清铁和氧化铜的混合物粉末放入足量稀盐酸中,发生的反应有哪些,残留固体的成分是什么.

 阅读快车系列答案
阅读快车系列答案现有10.6g碳酸钠和8.4g碳酸氢钠,分别与过量盐酸反应,其中( )
|
| A. | 碳酸钠消耗的氯化氢多 | B. | 碳酸氢钠生成的二氧化碳多 |
|
| C. | 碳酸氢钠消耗的氯化氢多 | D. | 碳酸氢钠生成的二氧化碳多 |
 .过氧比苯甲酰由三种元素组成
.过氧比苯甲酰由三种元素组成 )
) 二氧化碳和氮气
二氧化碳和氮气