题目内容
1.铁和铜是生活中常见的两种金属.让我们与甲、乙化学兴趣小组一起踏上探究之旅吧!(一)兴趣小组甲:久置的铜制品表面能生成 Cu2(OH)2CO3.甲组同学以锈蚀严重的废铜 屑为原料(假设不含其他杂质)制取纯铜.如图是兴趣小组设计的两种回收铜的实验方案:
查阅资料:Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑
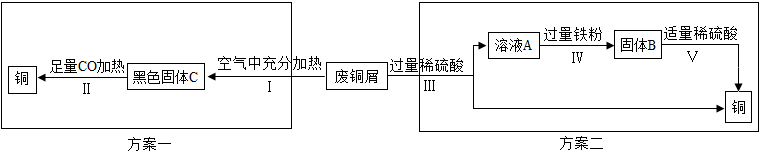
【分析评价】(1)步骤Ⅱ中 CO 的作用是A(填字母).A.还原剂B.氧化剂
(2)步骤Ⅲ、Ⅳ、Ⅴ都需要进行的实验操作是过滤.
(3)步骤Ⅴ过程发生反应的化学方程式为Fe+H2SO4═FeSO4+H2↑.
(4)同一份废铜屑分别通过上述两种方案最终得到的铜的质量:方案一=(填“>”或“=”或“<”)方案二.以上两种方案中,方案二优越于方案一,理由是操作简单(答一点).
【拓展探究】在方案一中,小明和小丽分别取 24 克氧化铜,用 CO 还原,小明得到 19.2克红色固体,小丽得到 20.8 克红色固体.为什么两人得到的红色固体质量不相等?查阅资料:
Ⅰ.CO 还原 CuO 时也可产生红色的氧化亚铜(Cu2O)Ⅱ.Cu2O+H2SO4(稀)═Cu+CuSO4+H2O
他们分析推断:
(1)一致认为小明(填“小明”或“小丽”)的产物中没有 Cu2O;
(2)用 CO 还原 8 克 CuO 得到红色固体 a 克,若红色固体为 Cu 和 Cu2O 的混合物,则
a 的取值范围为6.4<a<7.2;
(3)可以用简单的实验验证红色固体中是否有 Cu2O,请简述操作、现象及结论:取样滴加足量的稀硫酸,若溶液变蓝,说明含Cu2O.
(二)兴趣小组乙:乙组同学对铁的锈蚀产生了浓厚的兴趣. 铁生锈是铁与空气中的一些物质反应生成氢氧化亚铁后,在空气中被氧化为氢氧化铁,氢氧化铁在日光照射下,缓慢分解,生成氧化铁 Fe2O3.铁锈的化学式可简单表示为 Fe2O3•nH2O.
【提出问题】铁锈(Fe2O3•nH2O)中 n 的值等于多少?
【查阅资料】(1)浓硫酸具有吸水性,是一种常用的液体干燥剂;碱石灰(是氢氧化钠 和氧化钙的混合物)可以吸收水和二氧化碳.
(2)Fe2O3•nH2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+nH2O
【问题探究】同学们发现实验室中有一保管不善的铁粉,大部分已经结块成红褐色,为了 探究铁锈(Fe2O3•nH2O)的组成,称取 27g 这种部分锈蚀的铁粉样品(假 设不含其他杂质),按如图1所示装置进行实验.
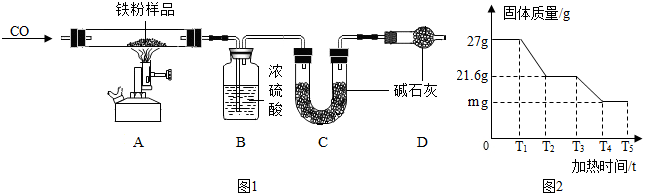
(1)实验开始前,连接好仪器并检查装置的气密性.
(2)实验中观察到 A 中的现象是固体逐渐变为黑色;请指出该装置中有一处明显不足未进行尾气处理.
【数据处理】以下是 B、C 中质量不再变化时 B 中浓硫酸、C 中碱石灰装置质量变化情况,以及 A 中固体质量和加热时间的关系图(T5 后 A 中固体质量不再变化).
| 反应前(g) | 反应后(g) | |
| B | 100 | 105.4 |
| C | 150 | 163.2 |
(4)n 的值为3.若没有装置 D,则 n 的值将偏小(填“偏大”或“偏小”或“无 影响”).
(5)关系图中 m 的值为16.8.
分析 (一)一氧化碳具有还原性,可以用作冶炼金属的还原剂;
步骤Ⅲ、Ⅳ、Ⅴ都需要进行的实验操作是过滤,通过过滤可以把固体和液体分离;
步骤Ⅴ过程中,铁能和稀硫酸反应生成硫酸亚铁和氢气;
不同的实验装置,优缺点不同;
硫酸铜溶液是蓝色溶液;
(二)
凡是有气体参加或产生的实验,实验前一定要检查装置的气密性,以防装置漏气影响实验结果;
高温条件下,氧化铁和一氧化碳反应生成铁和二氧化碳;
一氧化碳有毒,扩散到空气中污染环境;
浓硫酸能够吸收水,碱石灰能够吸收水和二氧化碳;
根据反应的化学方程式及其提供的数据可以进行相关方面的计算和判断.
解答 解:(一)
【分析评价】(1)步骤Ⅱ中 CO 的作用是还原剂.
故填:A.
(2)步骤Ⅲ、Ⅳ、Ⅴ都需要进行的实验操作是过滤.
故填:过滤.
(3)步骤Ⅴ过程中,铁和稀硫酸反应生成硫酸亚铁和氢气,发生反应的化学方程式为:Fe+H2SO4═FeSO4+H2↑.
故填:Fe+H2SO4═FeSO4+H2↑.
(4)同一份废铜屑分别通过上述两种方案最终得到的铜的质量相等,这是因为两种方案中铜元素没有流失;
以上两种方案中,方案二优越于方案一,理由是操作简单.
故填:=;操作简单.
【拓展探究】(1)一致认为小明的产物中没有 Cu2O,这是因为 24 克氧化铜中铜元素质量是19.2g.
故填:小明.
(2)如果红色固体都是铜,则红色固体质量是:8g×$\frac{64}{80}$×100%=6.4g,
如果红色固体都是氧化亚铜,则红色固体质量为:6.4g÷$\frac{128}{144}$×100%=7.2g,
若红色固体为 Cu 和 Cu2O 的混合物,则a 的取值范围为6.4<a<7.2.
故填:6.4<a<7.2.
(3)实验验证红色固体中是否有 Cu2O的操作、现象及结论:取样滴加足量的稀硫酸,若溶液变蓝,说明含 Cu2O.
故填:取样滴加足量的稀硫酸,若溶液变蓝,说明含 Cu2O.
(二)
(1)实验开始前,连接好仪器并检查装置的气密性.
故填:检查装置的气密性.
(2)实验中观察到 A 中的现象是:固体逐渐变为黑色;
该装置中有一处明显不足是未进行尾气处理.
故填:固体逐渐变为黑色;未进行尾气处理.
(3)装置 C 的作用是吸收生成的二氧化碳;
装置 B 和 C 不能颠倒,这是因为如果颠倒,则生成的水和二氧化碳都被碱石灰吸收;
写T3~T4 时间段,氧化铁和一氧化碳反应生成铁和二氧化碳,发生的化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
故填:吸收生成的二氧化碳;否;Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(4)由表中数据可知,反应生成水的质量为:105.4g-100g=5.4g,
反应生成二氧化碳的质量为:163.2g-150g=13.2g,
设氧化铁的质量为x,
Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,
160 132
x 13.2g
$\frac{160}{x}$=$\frac{132}{13.2g}$,
x=16g,
根据题意有:Fe2O3•nH2O,
160 18n
16g 5.4g
$\frac{160}{16g}$=$\frac{18n}{5.4g}$,
n=3,
若没有装置 D,则由上面计算n的值可知,n的值将偏小.
故填:3;偏小.
(5)关系图中m的值为混合物中铁的质量和反应生成的铁的质量之和,铁的质量为:27g-(16g+5.4g)+16g×$\frac{112}{160}$×100%=16.8g,
故填:16.8.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案| 现象或事实 | 原因或解释 | |
| A | 用活性炭去除冰箱异味 | 活性炭有吸附性 |
| B | 蜡烛一吹即灭 | 冷空气降低了蜡烛的着火点 |
| C | 用洗洁精去除餐具油污 | 洗洁精有溶解油污的作用 |
| D | 去山洞探险时要做灯火实验 | 实验山洞内是否有氧气 |
| A. | A | B. | B | C. | C | D. | D |
【提出问题】一定金属与盐酸反应快慢受哪些因素的影响呢?
【猜想与假设】a.可能与盐酸的浓度有关;b.可能与反应时的温度有关.
【设计并进行实验】小明用不同质量分数的盐酸和相同形状的铝片进行如下实验.
| 实验编号 | 盐酸的浓度(均取20mL) | 温度/℃ | 收集40mL气体所需时间/s |
| ① | 5% | 30 | 48 |
| ② | 10% | 20 | 41 |
| ③ | 5% | 20 | 69 |
| ④ | 10% | 30 | 32 |
(1)写出铝与盐酸反应的化学方程式2Al+6HCl=2AlCl3+3H2↑.
(2)通过实验②③对比,说明其他条件相同时,盐酸的浓度越大,反应速率越快;通过实验①③或②④(写编号)对比,说明反应时的温度对反应快慢有影响.
(3)如果盐酸的浓度为10%,温度为25℃,则收集40mL气体所需的时间范围为32s<t<41s.
(4)小明在做以上四组实验时,发现一开始反应速率都很慢,原因是铝片可能没有打磨,实验前没有除去铝表面的氧化膜.
(5)还有哪些因素会影响金属与酸的反应快慢金属的形状(或金属的纯度或反应物的量).
| A. | 用pH试纸测得溶液的pH=2.6 | |
| B. | 铵态氮肥与熟石灰共热放出无色无味的气体 | |
| C. | 酚酞试液遇稀硫酸变成红色 | |
| D. | 面包片遇到碘酒后变蓝 |
 已知蜡烛的着火点约为190℃,蜡烛的火焰由气态蜡燃烧形成,如图所示,在温度示数为280℃以上时,快速推动火塞,观察到蜡烛立即熄灭,其主要原因是( )
已知蜡烛的着火点约为190℃,蜡烛的火焰由气态蜡燃烧形成,如图所示,在温度示数为280℃以上时,快速推动火塞,观察到蜡烛立即熄灭,其主要原因是( )| A. | 隔绝氧气 | B. | 移走可燃物 | ||
| C. | 降温到着火点以下 | D. | 无法判断 |
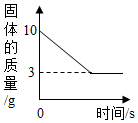 某同学取Fe粉与Cu粉混合物样品,加入足量的稀盐酸,待反应完全后过滤,称得固体质量如图所示,试计算:
某同学取Fe粉与Cu粉混合物样品,加入足量的稀盐酸,待反应完全后过滤,称得固体质量如图所示,试计算:


 如图为用红磷探究质量守恒定律的实验装置图.请完成下列探究过程:
如图为用红磷探究质量守恒定律的实验装置图.请完成下列探究过程: