题目内容
11.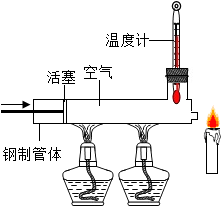 已知蜡烛的着火点约为190℃,蜡烛的火焰由气态蜡燃烧形成,如图所示,在温度示数为280℃以上时,快速推动火塞,观察到蜡烛立即熄灭,其主要原因是( )
已知蜡烛的着火点约为190℃,蜡烛的火焰由气态蜡燃烧形成,如图所示,在温度示数为280℃以上时,快速推动火塞,观察到蜡烛立即熄灭,其主要原因是( )| A. | 隔绝氧气 | B. | 移走可燃物 | ||
| C. | 降温到着火点以下 | D. | 无法判断 |
分析 灭火的原理有:(1)与空气(或氧气)隔绝.(2)降温到可燃物的着火点以下.(3)清除可燃物;可燃物的着火点是物质本身的一种属性,一般情况下不能改变.
解答 解:蜡烛的着火点约为190℃,蜡烛的火焰由气态蜡燃烧形成.如图所示,在温度计示数为280℃以上时,快速推动活塞,使气态石蜡被赶走,所以观察到蜡烛立即熄灭,故蜡烛熄灭的主要原因是移走可燃物.
A、快速推动活塞,使气态石蜡被赶走,所以观察到蜡烛立即熄灭,故蜡烛熄灭的主要原因是移走可燃物,而不是隔绝氧气,故选项错误.
B、快速推动活塞,使气态石蜡被赶走,所以观察到蜡烛立即熄灭,故蜡烛熄灭的主要原因是移走可燃物,故选项正确.
C、快速推动活塞,使气态石蜡被赶走,所以观察到蜡烛立即熄灭,故蜡烛熄灭的主要原因是移走可燃物,而不是降低温度至着火点以下,故选项错误.
D、快速推动活塞,使气态石蜡被赶走,所以观察到蜡烛立即熄灭,故蜡烛熄灭的主要原因是移走可燃物,故选项错误.
故选:B.
点评 本题难度不大,掌握灭火的原理(清除或隔离可燃物、隔绝氧气或空气、使温度降到可燃物的着火点以下)并能灵活运用是正确解答此类题的关键.

练习册系列答案
相关题目
1.铁和铜是生活中常见的两种金属.让我们与甲、乙化学兴趣小组一起踏上探究之旅吧!
(一)兴趣小组甲:久置的铜制品表面能生成 Cu2(OH)2CO3.甲组同学以锈蚀严重的废铜 屑为原料(假设不含其他杂质)制取纯铜.如图是兴趣小组设计的两种回收铜的实验方案:
查阅资料:Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑
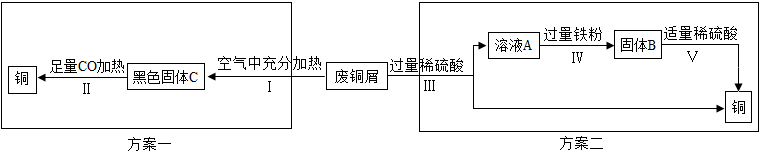
【分析评价】(1)步骤Ⅱ中 CO 的作用是A(填字母).A.还原剂B.氧化剂
(2)步骤Ⅲ、Ⅳ、Ⅴ都需要进行的实验操作是过滤.
(3)步骤Ⅴ过程发生反应的化学方程式为Fe+H2SO4═FeSO4+H2↑.
(4)同一份废铜屑分别通过上述两种方案最终得到的铜的质量:方案一=(填“>”或“=”或“<”)方案二.以上两种方案中,方案二优越于方案一,理由是操作简单(答一点).
【拓展探究】在方案一中,小明和小丽分别取 24 克氧化铜,用 CO 还原,小明得到 19.2克红色固体,小丽得到 20.8 克红色固体.为什么两人得到的红色固体质量不相等?查阅资料:
Ⅰ.CO 还原 CuO 时也可产生红色的氧化亚铜(Cu2O)Ⅱ.Cu2O+H2SO4(稀)═Cu+CuSO4+H2O
他们分析推断:
(1)一致认为小明(填“小明”或“小丽”)的产物中没有 Cu2O;
(2)用 CO 还原 8 克 CuO 得到红色固体 a 克,若红色固体为 Cu 和 Cu2O 的混合物,则
a 的取值范围为6.4<a<7.2;
(3)可以用简单的实验验证红色固体中是否有 Cu2O,请简述操作、现象及结论:取样滴加足量的稀硫酸,若溶液变蓝,说明含Cu2O.
(二)兴趣小组乙:乙组同学对铁的锈蚀产生了浓厚的兴趣. 铁生锈是铁与空气中的一些物质反应生成氢氧化亚铁后,在空气中被氧化为氢氧化铁,氢氧化铁在日光照射下,缓慢分解,生成氧化铁 Fe2O3.铁锈的化学式可简单表示为 Fe2O3•nH2O.
【提出问题】铁锈(Fe2O3•nH2O)中 n 的值等于多少?
【查阅资料】(1)浓硫酸具有吸水性,是一种常用的液体干燥剂;碱石灰(是氢氧化钠 和氧化钙的混合物)可以吸收水和二氧化碳.
(2)Fe2O3•nH2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+nH2O
【问题探究】同学们发现实验室中有一保管不善的铁粉,大部分已经结块成红褐色,为了 探究铁锈(Fe2O3•nH2O)的组成,称取 27g 这种部分锈蚀的铁粉样品(假 设不含其他杂质),按如图1所示装置进行实验.
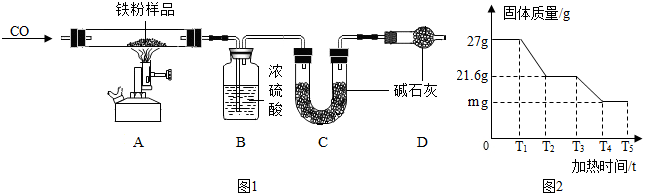
(1)实验开始前,连接好仪器并检查装置的气密性.
(2)实验中观察到 A 中的现象是固体逐渐变为黑色;请指出该装置中有一处明显不足未进行尾气处理.
【数据处理】以下是 B、C 中质量不再变化时 B 中浓硫酸、C 中碱石灰装置质量变化情况,以及 A 中固体质量和加热时间的关系图(T5 后 A 中固体质量不再变化).
(3)装置 C 的作用是吸收生成的二氧化碳.装置 B 和 C 是否可以颠倒?否(填“是”或“否”). 写出 T3~T4 时间段发生的化学方程式Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(4)n 的值为3.若没有装置 D,则 n 的值将偏小(填“偏大”或“偏小”或“无 影响”).
(5)关系图中 m 的值为16.8.
(一)兴趣小组甲:久置的铜制品表面能生成 Cu2(OH)2CO3.甲组同学以锈蚀严重的废铜 屑为原料(假设不含其他杂质)制取纯铜.如图是兴趣小组设计的两种回收铜的实验方案:
查阅资料:Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑

【分析评价】(1)步骤Ⅱ中 CO 的作用是A(填字母).A.还原剂B.氧化剂
(2)步骤Ⅲ、Ⅳ、Ⅴ都需要进行的实验操作是过滤.
(3)步骤Ⅴ过程发生反应的化学方程式为Fe+H2SO4═FeSO4+H2↑.
(4)同一份废铜屑分别通过上述两种方案最终得到的铜的质量:方案一=(填“>”或“=”或“<”)方案二.以上两种方案中,方案二优越于方案一,理由是操作简单(答一点).
【拓展探究】在方案一中,小明和小丽分别取 24 克氧化铜,用 CO 还原,小明得到 19.2克红色固体,小丽得到 20.8 克红色固体.为什么两人得到的红色固体质量不相等?查阅资料:
Ⅰ.CO 还原 CuO 时也可产生红色的氧化亚铜(Cu2O)Ⅱ.Cu2O+H2SO4(稀)═Cu+CuSO4+H2O
他们分析推断:
(1)一致认为小明(填“小明”或“小丽”)的产物中没有 Cu2O;
(2)用 CO 还原 8 克 CuO 得到红色固体 a 克,若红色固体为 Cu 和 Cu2O 的混合物,则
a 的取值范围为6.4<a<7.2;
(3)可以用简单的实验验证红色固体中是否有 Cu2O,请简述操作、现象及结论:取样滴加足量的稀硫酸,若溶液变蓝,说明含Cu2O.
(二)兴趣小组乙:乙组同学对铁的锈蚀产生了浓厚的兴趣. 铁生锈是铁与空气中的一些物质反应生成氢氧化亚铁后,在空气中被氧化为氢氧化铁,氢氧化铁在日光照射下,缓慢分解,生成氧化铁 Fe2O3.铁锈的化学式可简单表示为 Fe2O3•nH2O.
【提出问题】铁锈(Fe2O3•nH2O)中 n 的值等于多少?
【查阅资料】(1)浓硫酸具有吸水性,是一种常用的液体干燥剂;碱石灰(是氢氧化钠 和氧化钙的混合物)可以吸收水和二氧化碳.
(2)Fe2O3•nH2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+nH2O
【问题探究】同学们发现实验室中有一保管不善的铁粉,大部分已经结块成红褐色,为了 探究铁锈(Fe2O3•nH2O)的组成,称取 27g 这种部分锈蚀的铁粉样品(假 设不含其他杂质),按如图1所示装置进行实验.

(1)实验开始前,连接好仪器并检查装置的气密性.
(2)实验中观察到 A 中的现象是固体逐渐变为黑色;请指出该装置中有一处明显不足未进行尾气处理.
【数据处理】以下是 B、C 中质量不再变化时 B 中浓硫酸、C 中碱石灰装置质量变化情况,以及 A 中固体质量和加热时间的关系图(T5 后 A 中固体质量不再变化).
| 反应前(g) | 反应后(g) | |
| B | 100 | 105.4 |
| C | 150 | 163.2 |
(4)n 的值为3.若没有装置 D,则 n 的值将偏小(填“偏大”或“偏小”或“无 影响”).
(5)关系图中 m 的值为16.8.
2.下列变化属于化学变化的是( )
| A. | 电灯通电发光 | B. | 燃放烟花爆竹 | C. | 自行车胎放炮 | D. | 酒精挥发 |
6.下列化学方程式及其书写正确的是( )
| A. | Fe+O2$\frac{\underline{\;点燃\;}}{\;}$FeO2 | B. | NaOH+CuSO4═Cu(OH)2↓+Na2SO4 | ||
| C. | 2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2↑ | D. | 2A1+6HC1═2A1C13+3H2↑ |
16.下列有关SO2的说法中,错误的是( )
| A. | 表示一个二氧化硫分子 | |
| B. | 由硫和氧气两种物质组成 | |
| C. | 物质名称是“二氧化硫” | |
| D. | 每个分子是由两个氧原子和一个硫原子构成的 |
20.如图是钠元素和氯元素在元素周期表中的信息和有关的4种粒子结构示意图.下列说法正确的是( )


| A. | c和d所含质子数不同 | B. | 钠、氯都属于金属元素 | ||
| C. | 氯的相对原子质量是35.45g | D. | 粒子a和d都是离子 |
 A~I是目前我们已学的常见物质,它们的相互转化关系如图所示(有反应条件、反应物和生成物未给出).已知A、D是组成元素相同的无色气体;G、F组成元素也相同,在常温下都是液体,E是最理想能源物质;C是世界上产量最高的金属.
A~I是目前我们已学的常见物质,它们的相互转化关系如图所示(有反应条件、反应物和生成物未给出).已知A、D是组成元素相同的无色气体;G、F组成元素也相同,在常温下都是液体,E是最理想能源物质;C是世界上产量最高的金属. 人体缺乏维生素C(简称Vc)可能患坏血病,如图为某种“维生素C”说明书的一部分,请回答:
人体缺乏维生素C(简称Vc)可能患坏血病,如图为某种“维生素C”说明书的一部分,请回答: