题目内容
20.小明学习金属有关知识后,对“一定金属和盐酸反应快慢的影响因素”进行了探究.【提出问题】一定金属与盐酸反应快慢受哪些因素的影响呢?
【猜想与假设】a.可能与盐酸的浓度有关;b.可能与反应时的温度有关.
【设计并进行实验】小明用不同质量分数的盐酸和相同形状的铝片进行如下实验.
| 实验编号 | 盐酸的浓度(均取20mL) | 温度/℃ | 收集40mL气体所需时间/s |
| ① | 5% | 30 | 48 |
| ② | 10% | 20 | 41 |
| ③ | 5% | 20 | 69 |
| ④ | 10% | 30 | 32 |
(1)写出铝与盐酸反应的化学方程式2Al+6HCl=2AlCl3+3H2↑.
(2)通过实验②③对比,说明其他条件相同时,盐酸的浓度越大,反应速率越快;通过实验①③或②④(写编号)对比,说明反应时的温度对反应快慢有影响.
(3)如果盐酸的浓度为10%,温度为25℃,则收集40mL气体所需的时间范围为32s<t<41s.
(4)小明在做以上四组实验时,发现一开始反应速率都很慢,原因是铝片可能没有打磨,实验前没有除去铝表面的氧化膜.
(5)还有哪些因素会影响金属与酸的反应快慢金属的形状(或金属的纯度或反应物的量).
分析 (1)根据铝和盐酸反应生成氯化铝和氢气进行分析;
(2)根据实验①③中盐酸的质量分数,温度不同,以及控制变量法进行分析;
(3)根据实验①、③中盐酸的质量分数,以及反应的温度,分析盐酸质量分数为5%,温度为25℃,则收集40mL气体所需的时间;
(4)根据铝的化学性质活泼,易于氧气反应生成氧化铝进行分析;
(5)反应物浓度、反应温度、反应物接触面积、有无催化剂等因素常影响化学反应速率.
解答 解:(1)铝和盐酸反应生成氯化铝和氢气,化学方程式为:Zn+2HCl=ZnCl2+H2↑;
(2)实验①③或②④中盐酸的质量分数相同,温度不同,说明反应时的温度对反应快慢有影响,通过实验②③说明反应物浓度对反应快慢有影响;
(3)实验②中盐酸的浓度是10温度是30℃,需要的时间是41,实验④中盐酸的浓度是10温度是20℃,需要的时间是32,所以盐酸质量分数为,10度为25℃,则收集40mL气体所需的时间范围为:32s<t<41s;
(4)小明在做以上四组实验时,发现一开始反应速率都很慢,原因是:实验前没有除去铝表面的氧化膜;
(5)金属的形状,金属的纯度,反应物的量等因素也会影响化学反应的速率.
故答案为:
(1)2Al+6HCl=2AlCl3+3H2↑;
(2)其他条件相同时,盐酸的浓度越大,反应速率越快; ①③或②④;
(3)32s<t<41s;
(4)铝片可能没有打磨,实验前没有除去铝表面的氧化膜;
(5)金属的形状(或金属的纯度或反应物的量)(答案合理即可).
点评 本题以影响产生氢气的反应速率为实验探究的形式考查了反应物浓度、颗粒的大小、反应温度等因素对化学反应速率的影响,重点在于培养学生的实验探究能力,注意控制变量的运用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
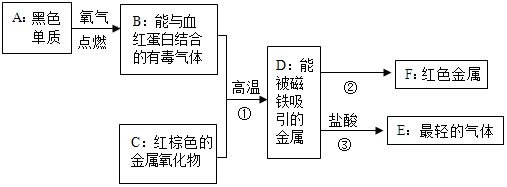
11. 在宏观、微观和符号之间建立联系是化学学科的特点.
在宏观、微观和符号之间建立联系是化学学科的特点.
(1)萨罗(Salol)是一种消毒剂,其分子模型如图所示:该物质的一个分子中含有26个原子;萨罗(Salol)中氧元素的质量分数为22.4%.
(2)A、B、C、D表示4种物质,部分物质的微观示意图如表.A和B在一定条件下反应生成C和D.
请回答一下问题:
①A、B、C、D中属于单质的是B(填字母序号,下同);属于氧化物的是CD.
②A、B、C、D四种物质中由分子构成的是ABCD.
③若一定质量的A和4.8gB恰好完全反应,可生成4.4gC和2.7gD,则A中一定含有的元素是C、H、O,其化学式为C2H6O.
 在宏观、微观和符号之间建立联系是化学学科的特点.
在宏观、微观和符号之间建立联系是化学学科的特点.(1)萨罗(Salol)是一种消毒剂,其分子模型如图所示:该物质的一个分子中含有26个原子;萨罗(Salol)中氧元素的质量分数为22.4%.
(2)A、B、C、D表示4种物质,部分物质的微观示意图如表.A和B在一定条件下反应生成C和D.
| 物质 | B | C | D | 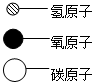 |
微观示意图 |  |  |  |
①A、B、C、D中属于单质的是B(填字母序号,下同);属于氧化物的是CD.
②A、B、C、D四种物质中由分子构成的是ABCD.
③若一定质量的A和4.8gB恰好完全反应,可生成4.4gC和2.7gD,则A中一定含有的元素是C、H、O,其化学式为C2H6O.
15.下列各组离子在pH=l或pH=10的溶液中都能大量共存的是( )
| A. | C u2+、Mg2+、NO3ˉ、SO42ˉ | B. | Na+、H+、NO3ˉ、SO42ˉ | ||
| C. | K+、Na2+、CO32ˉ、SO42ˉ | D. | K+、Clˉ、Ba2+、NO3ˉ |
1.铁和铜是生活中常见的两种金属.让我们与甲、乙化学兴趣小组一起踏上探究之旅吧!
(一)兴趣小组甲:久置的铜制品表面能生成 Cu2(OH)2CO3.甲组同学以锈蚀严重的废铜 屑为原料(假设不含其他杂质)制取纯铜.如图是兴趣小组设计的两种回收铜的实验方案:
查阅资料:Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑
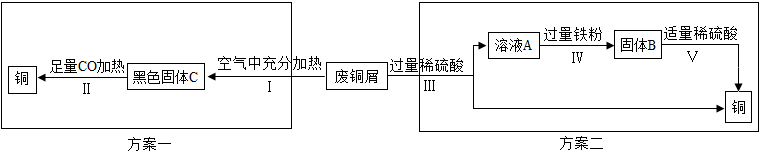
【分析评价】(1)步骤Ⅱ中 CO 的作用是A(填字母).A.还原剂B.氧化剂
(2)步骤Ⅲ、Ⅳ、Ⅴ都需要进行的实验操作是过滤.
(3)步骤Ⅴ过程发生反应的化学方程式为Fe+H2SO4═FeSO4+H2↑.
(4)同一份废铜屑分别通过上述两种方案最终得到的铜的质量:方案一=(填“>”或“=”或“<”)方案二.以上两种方案中,方案二优越于方案一,理由是操作简单(答一点).
【拓展探究】在方案一中,小明和小丽分别取 24 克氧化铜,用 CO 还原,小明得到 19.2克红色固体,小丽得到 20.8 克红色固体.为什么两人得到的红色固体质量不相等?查阅资料:
Ⅰ.CO 还原 CuO 时也可产生红色的氧化亚铜(Cu2O)Ⅱ.Cu2O+H2SO4(稀)═Cu+CuSO4+H2O
他们分析推断:
(1)一致认为小明(填“小明”或“小丽”)的产物中没有 Cu2O;
(2)用 CO 还原 8 克 CuO 得到红色固体 a 克,若红色固体为 Cu 和 Cu2O 的混合物,则
a 的取值范围为6.4<a<7.2;
(3)可以用简单的实验验证红色固体中是否有 Cu2O,请简述操作、现象及结论:取样滴加足量的稀硫酸,若溶液变蓝,说明含Cu2O.
(二)兴趣小组乙:乙组同学对铁的锈蚀产生了浓厚的兴趣. 铁生锈是铁与空气中的一些物质反应生成氢氧化亚铁后,在空气中被氧化为氢氧化铁,氢氧化铁在日光照射下,缓慢分解,生成氧化铁 Fe2O3.铁锈的化学式可简单表示为 Fe2O3•nH2O.
【提出问题】铁锈(Fe2O3•nH2O)中 n 的值等于多少?
【查阅资料】(1)浓硫酸具有吸水性,是一种常用的液体干燥剂;碱石灰(是氢氧化钠 和氧化钙的混合物)可以吸收水和二氧化碳.
(2)Fe2O3•nH2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+nH2O
【问题探究】同学们发现实验室中有一保管不善的铁粉,大部分已经结块成红褐色,为了 探究铁锈(Fe2O3•nH2O)的组成,称取 27g 这种部分锈蚀的铁粉样品(假 设不含其他杂质),按如图1所示装置进行实验.
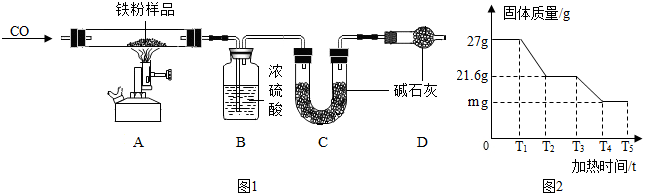
(1)实验开始前,连接好仪器并检查装置的气密性.
(2)实验中观察到 A 中的现象是固体逐渐变为黑色;请指出该装置中有一处明显不足未进行尾气处理.
【数据处理】以下是 B、C 中质量不再变化时 B 中浓硫酸、C 中碱石灰装置质量变化情况,以及 A 中固体质量和加热时间的关系图(T5 后 A 中固体质量不再变化).
(3)装置 C 的作用是吸收生成的二氧化碳.装置 B 和 C 是否可以颠倒?否(填“是”或“否”). 写出 T3~T4 时间段发生的化学方程式Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(4)n 的值为3.若没有装置 D,则 n 的值将偏小(填“偏大”或“偏小”或“无 影响”).
(5)关系图中 m 的值为16.8.
(一)兴趣小组甲:久置的铜制品表面能生成 Cu2(OH)2CO3.甲组同学以锈蚀严重的废铜 屑为原料(假设不含其他杂质)制取纯铜.如图是兴趣小组设计的两种回收铜的实验方案:
查阅资料:Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑

【分析评价】(1)步骤Ⅱ中 CO 的作用是A(填字母).A.还原剂B.氧化剂
(2)步骤Ⅲ、Ⅳ、Ⅴ都需要进行的实验操作是过滤.
(3)步骤Ⅴ过程发生反应的化学方程式为Fe+H2SO4═FeSO4+H2↑.
(4)同一份废铜屑分别通过上述两种方案最终得到的铜的质量:方案一=(填“>”或“=”或“<”)方案二.以上两种方案中,方案二优越于方案一,理由是操作简单(答一点).
【拓展探究】在方案一中,小明和小丽分别取 24 克氧化铜,用 CO 还原,小明得到 19.2克红色固体,小丽得到 20.8 克红色固体.为什么两人得到的红色固体质量不相等?查阅资料:
Ⅰ.CO 还原 CuO 时也可产生红色的氧化亚铜(Cu2O)Ⅱ.Cu2O+H2SO4(稀)═Cu+CuSO4+H2O
他们分析推断:
(1)一致认为小明(填“小明”或“小丽”)的产物中没有 Cu2O;
(2)用 CO 还原 8 克 CuO 得到红色固体 a 克,若红色固体为 Cu 和 Cu2O 的混合物,则
a 的取值范围为6.4<a<7.2;
(3)可以用简单的实验验证红色固体中是否有 Cu2O,请简述操作、现象及结论:取样滴加足量的稀硫酸,若溶液变蓝,说明含Cu2O.
(二)兴趣小组乙:乙组同学对铁的锈蚀产生了浓厚的兴趣. 铁生锈是铁与空气中的一些物质反应生成氢氧化亚铁后,在空气中被氧化为氢氧化铁,氢氧化铁在日光照射下,缓慢分解,生成氧化铁 Fe2O3.铁锈的化学式可简单表示为 Fe2O3•nH2O.
【提出问题】铁锈(Fe2O3•nH2O)中 n 的值等于多少?
【查阅资料】(1)浓硫酸具有吸水性,是一种常用的液体干燥剂;碱石灰(是氢氧化钠 和氧化钙的混合物)可以吸收水和二氧化碳.
(2)Fe2O3•nH2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+nH2O
【问题探究】同学们发现实验室中有一保管不善的铁粉,大部分已经结块成红褐色,为了 探究铁锈(Fe2O3•nH2O)的组成,称取 27g 这种部分锈蚀的铁粉样品(假 设不含其他杂质),按如图1所示装置进行实验.

(1)实验开始前,连接好仪器并检查装置的气密性.
(2)实验中观察到 A 中的现象是固体逐渐变为黑色;请指出该装置中有一处明显不足未进行尾气处理.
【数据处理】以下是 B、C 中质量不再变化时 B 中浓硫酸、C 中碱石灰装置质量变化情况,以及 A 中固体质量和加热时间的关系图(T5 后 A 中固体质量不再变化).
| 反应前(g) | 反应后(g) | |
| B | 100 | 105.4 |
| C | 150 | 163.2 |
(4)n 的值为3.若没有装置 D,则 n 的值将偏小(填“偏大”或“偏小”或“无 影响”).
(5)关系图中 m 的值为16.8.
5.有关催化剂的说法错误的是( )
| A. | 反应前后本身质量不变 | B. | 反应前后化学性质不变 | ||
| C. | 一定加快化学反应速率 | D. | 可能减慢化学反应速率 |
6.下列化学方程式及其书写正确的是( )
| A. | Fe+O2$\frac{\underline{\;点燃\;}}{\;}$FeO2 | B. | NaOH+CuSO4═Cu(OH)2↓+Na2SO4 | ||
| C. | 2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2↑ | D. | 2A1+6HC1═2A1C13+3H2↑ |
 钨(W)是我国丰产元素,广泛用作灯泡的灯丝,有“光明使者”的美誉.
钨(W)是我国丰产元素,广泛用作灯泡的灯丝,有“光明使者”的美誉.