题目内容
19.金属钠投入到NH4Cl溶液中,钠浮在液面上,熔成小球,四处游动,并生成大量气体.为确定气体的成分,进行下列实验探究.(1)猜想:气体可能是HCl、NH3、H2中的一种或几种,作此猜想的理论依据是化学反应前后元素种类保持不变.
(2)实验:甲同学为判断气体成分,查阅资料得知:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O.
于是设计了如图实验装置:

(3)现象与结论:A中观察到酚酞试剂变红色,证明有NH3;B中玻璃管内观察到固体表面由黑色变红色,证明有H2.
(4)实验反思:
①浓硫酸的作用是吸收氨气和水.
②乙同学认为甲的设计不能确定是否含有HCl,于是他将气体通入酸化的硝酸银溶液溶液中,无白色沉淀产生,则该气体中无HCl(填“有”或“无”).
③写出Na与NH4Cl溶液反应的化学方程式2Na+2NH4Cl=2NH3↑+H2↑+2NaCl.
分析 (1)根据质量守恒定律来分析;
(3)根据实验现象来分析解答;
(4)浓硫酸是一种酸,且具有吸水性;检验氯离子的存在一般用酸化的硝酸银溶液;根据实验现象以及化学方程式的书写方法来分析.
解答 解:(1)由质量守恒定律可知,化学反应前后元素的种类不变,所以猜想可能是HCl、NH3、H2中的一种或几种,故填:化学反应前后元素种类保持不变;
(3)A中观察到酚酞试剂变红色,证明产生的气体中有一种能与水反应生成碱性物质,则为氨气,因为氨气与水反应生成氨水,氨水是一种碱,能使无色酚酞试液变红色;B中玻璃管内观察到固体表面由黑色变红色,说明该气体中含有具有还原性的气体,则为氢气;故填:NH3;H2;
(4)①当气体通过浓硫酸时,其中的氨气与硫酸发生了反应生成硫酸铵,水蒸气也被浓硫酸所吸收;故填:吸收氨气和水;
②检验气体中是否含有氯化氢气体,可将其通入酸化的硝酸银溶液,若看到有白色沉淀产生,则证明其中含有氯化氢气体,若没有白色沉淀生成,则不含氯化氢气体;故填:硝酸银溶液;无;
③由实验现象可知,该反应中生成了氨气和氢气,由质量守恒定律可知,钠与氯化铵反应还会生成氯化钠,故填:2Na+2NH4Cl=2NH3↑+H2↑+2NaCl.
点评 本题是一道实验和结论相结合的题目,可以根据所学知识来回答,难度不大.

练习册系列答案
相关题目
9.下列实验操作中错误的是( )
| A. |  蒸发结晶 | B. |  检查装置气密性 | C. |  滴管用毕即插回 | D. |  测定溶液的pH |
10.已知某甲醛(HCHO)的水溶液中,氢元素的质量分数为10%,则溶液中甲醛的质量分数为( )
| A. | 10% | B. | 20% | C. | 30% | D. | 25% |
7.下列叙述正确的是( )
| A. | 酸、碱中都一定含有氧元素 | |
| B. | 含有碳元素的化合物一定是有机物 | |
| C. | 在金属活动性顺序表中,氢前的金属能与盐酸反应 | |
| D. | 某溶液能使酚酞试液变红,可证明该溶液一定是碱溶液 |
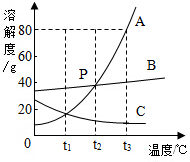 如图是A、B、C三种物质的溶解度曲线,回答下列问题:
如图是A、B、C三种物质的溶解度曲线,回答下列问题:

 如图是学生经常使用的交通工具.自行车,请完成下列各题:
如图是学生经常使用的交通工具.自行车,请完成下列各题: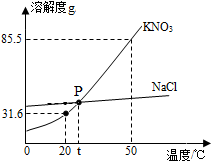 如图为NaCl和KNO3的溶解度曲线,请回答下列问题:
如图为NaCl和KNO3的溶解度曲线,请回答下列问题: