题目内容
9.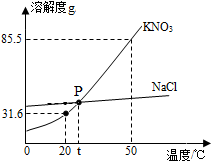 如图为NaCl和KNO3的溶解度曲线,请回答下列问题:
如图为NaCl和KNO3的溶解度曲线,请回答下列问题:(1)从图中获得一条信息是硝酸钾、氯化钠两种固体物质的溶解度,都是随温度升高而增大;
(2)将NaCl从其溶液中结晶出来的方法是蒸发结晶;
(3)某实验小组的同学取10g水域一定量KNO3进行了以下实验:
10g水$→_{搅拌(20℃)}^{加2.5gKNO_{3}}$X$→_{搅拌(20℃)}^{再加2.5gKNO_{3}}$Y$→_{至50℃}^{升温}$Z
①X、Y、Z中一定属于饱和溶液的是Y;
②X中溶质的质量分数是20%;若将其溶质的质量分数稀释至10%,需加水的质量是12.5g.
分析 根据题目信息和溶解度曲线可知:硝酸钾、氯化钠两种固体物质的溶解度,都是随温度升高而增大,而硝酸钾的溶解度随温度的升高变化比氯化钠大;将NaCl从其溶液中结晶出来的方法是蒸发结晶,因为氯化钠的溶解度受温度的影响很小;X、Y、Z中一定属于饱和溶液的是Y,因为硝酸钾在20℃的溶解度是31.6g;X中溶质的质量分数=$\frac{2.5g}{12.5g}×100%=20%$;若将其溶质的质量分数稀释至10%,需加水的质量是12.5g,因为溶液的质量分数减半,加水的质量是原溶液的一倍.
解答 解:(1)由溶解度曲线可知:硝酸钾、氯化钠两种固体物质的溶解度,都是随温度升高而增大,而硝酸钾的溶解度随温度的升高变化比氯化钠大,故答案为:硝酸钾、氯化钠两种固体物质的溶解度,都是随温度升高而增大(合理即可)
(2)将NaCl从其溶液中结晶出来的方法是蒸发结晶,因为氯化钠的溶解度受温度的影响很小;故答案为:蒸发结晶;
(3)X、Y、Z中一定属于饱和溶液的是Y,因为硝酸钾在20℃的溶解度是31.6g;X中溶质的质量分数=$\frac{2.5g}{12.5g}×100%=20%$;若将其溶质的质量分数稀释至10%,需加水的质量是12.5g,因为溶液的质量分数减半,加水的质量是原溶液的一倍;故答案为:①Y;②20%;③12.5g;
点评 本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液和溶质质量分数的计算,有关的计算要准确,本考点主要出现在选择题和填空题中.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
17.氢氧化钠是一种重要的化工原料,广泛应用于玻璃、造纸等行业,其俗称是( )
| A. | 纯碱 | B. | 小苏打 | C. | 消石灰 | D. | 烧碱 |
4. 如图所示,甲、乙是两种物质的溶解度曲线,下列叙述不正确的是( )
如图所示,甲、乙是两种物质的溶解度曲线,下列叙述不正确的是( )
 如图所示,甲、乙是两种物质的溶解度曲线,下列叙述不正确的是( )
如图所示,甲、乙是两种物质的溶解度曲线,下列叙述不正确的是( )| A. | 20℃时甲的溶解度大于乙的溶解度 | |
| B. | 60℃时,在100g水中加入100g甲,充分溶解后溶液的质量是200g | |
| C. | 40℃时,甲、乙两种物质饱和溶液中溶质的质量相等 | |
| D. | 采用升温的方法可将乙的不饱和溶液转化为饱和溶液 |
7.生产电脑芯片的材料主要是高纯硅,工业生产硅的原理为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,在反应中发生了还原反应的是( )
| A. | C | B. | SiO2 | C. | Si | D. | CO |
8.下列处理事故的方法中正确的是( )
| A. | 不慎碰倒酒精灯,酒精在桌面上燃烧起来,立即用水冲 | |
| B. | 炒菜时,锅里的油起火应立即端下油锅 | |
| C. | 厨房煤气管道漏气,立即关闭阀门并开窗通风 | |
| D. | 图书馆内图书起火,立即用泡沫灭火器扑灭 |


