题目内容
11.碱式碳酸盐广泛应用于工农业生产.某碱式碳酸盐样品M2(OH)2CO3,为确定金属M的相对原子质量,某研究小组设计如下实验装置及步骤(不考虑植物油溶解CO2的影响).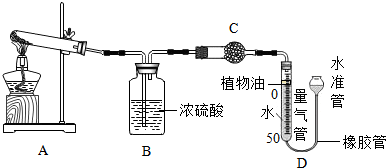
①连接装置并检查气密性;②称量样品的质量;③装药品,调节量气装置两边液面相平,读数;④加热至样品质量不再减少;⑤冷却到室温;⑥调节量气装置两边液面相平,读数、列式计算.
Ⅰ、请将上述实验步骤①补充完.
Ⅱ、装置B的作用是吸收水蒸气,少量植物油的作用是防止CO2溶于水,C中的试剂是C(填字母序号).
a、碱石灰 b、浓硫酸 c、硫酸铜.
Ⅲ、步骤⑥中调节液面相平的操作是将水准管缓慢下移(填“缓慢上移”或“缓慢下移”)Ⅳ、若其它操作均正确,因下列因素可使M相对原子质量的测定结果偏大的是b c(填字母序号).
a、反应前量气管水面到0刻度处,反应后仰视读数b、样品未分解完全即停止实验
c、量气管中未加植物油 d、实验步骤⑤中未冷却到室温.
分析 ①使用或制取气体的实验要求先检查装置的气密性;
Ⅱ、根据浓硫酸的吸水性可以干燥气体;少量植物油可以防止二氧化碳溶于水;硫酸铜可以验证二氧化碳气体是否干燥完全;
Ⅲ、根据液面越低压强越小进行解答;
Ⅳ、根据能使生成的气体体积增加考虑;
解答 解:①改装置使用时必须密封进行,所以实验前一定要先检查装置的气密性;
Ⅱ、浓硫酸的吸水性可以除去二氧化碳中的水;少量植物油可以隔离二氧化碳和水,防止二氧化碳溶于水;硫酸铜可以验证二氧化碳气体是否干燥完全;
Ⅲ、液面越低压强越小,所以加热A时,随着碳酸盐样品分解,量气管内的液面逐渐下降,为防止量气管内气体压强过大,可将水准管缓慢下移;
Ⅳ、本实验主要通过测量二氧化碳的体积,通过密度已知可以计算二氧化碳的质量,进而计算碳元素的质量,
根据$\frac{{M}_{C}}{M盐}$=$\frac{{m}_{C}}{m盐}$
得${M}_{盐}=\frac{{m}_{盐}}{{m}_{C}}{M}_{C}$,据此公式进行分析;
a、应前量气管水面到0刻度处,反应后仰视读数,读数偏大,二氧化碳体积偏大,mC偏大,M盐偏小;b、样品未分解完全即停止实验,可导致实际测得气体的体积偏小,mC偏小,M盐偏大;c、量气管中未加植物油,二氧化碳溶于水,可导致实际测得气体的体积偏小,mC偏小,M盐偏大,故选bc;
答案:(1)检查气密性;
Ⅱ、吸收水蒸气;防止CO2溶于水;C;
Ⅲ、缓慢下移;
Ⅳ、b c.
点评 本题通过提出问题、做出猜想、设计实验方案、进行实验等环节,体现了科学探究的一般过程.但本题计算量较大,要求学生对知识掌握程度较高,是一道综合性较强的题目的难题.

练习册系列答案
相关题目
15.为测定粗盐中氯化钠的质量分数,下列实验操作会使测得的结果偏大的是( )
| A. |  食盐没有全部溶解就过滤 | |
| B. |  蒸发过程中晶体飞溅 | |
| C. |  蒸发所得的精盐较潮湿 | |
| D. |  蒸发皿中的精盐没有全部转移到称量纸上 |
3.有A、B、C三种物质各1.5克,发生了如下的化学反应:A+B+C→D,充分反应后生成3.0克的D.在残留物中再加入1.0克A,反应继续进行.待反应再次停止,反应物中仅剩余有C.以下结论正确的是( )
| A. | 第一次反应停止时B剩余0.9克 | B. | 第一次反应停止时C剩余0.9克 | ||
| C. | 参加反应A与C的质量比是5:3 | D. | 第二次反应停止时C剩余0.9克 |
20. 如图所示,向盛水的烧杯中放入一小粒品红,一段时间后,烧杯中形成红色溶液,此实验能说明( )
如图所示,向盛水的烧杯中放入一小粒品红,一段时间后,烧杯中形成红色溶液,此实验能说明( )
 如图所示,向盛水的烧杯中放入一小粒品红,一段时间后,烧杯中形成红色溶液,此实验能说明( )
如图所示,向盛水的烧杯中放入一小粒品红,一段时间后,烧杯中形成红色溶液,此实验能说明( )| A. | 分子处于不断运动之中 | B. | 分子之间有间隔 | ||
| C. | 分子可再分,原子不能再分 | D. | 分子大,原子小 |


 菠菜柔软滑嫩、味美色鲜,但菠菜中草酸含量较高,如果食用含草酸较多的食物,尿中草酸含量明显增多,尿路结石的危险性也随之增加.小科通过查资料得知,草酸的化学式为H2C2O4,并且草酸受热会分解,他对草酸受热分解及其产物的检验做了探究:
菠菜柔软滑嫩、味美色鲜,但菠菜中草酸含量较高,如果食用含草酸较多的食物,尿中草酸含量明显增多,尿路结石的危险性也随之增加.小科通过查资料得知,草酸的化学式为H2C2O4,并且草酸受热会分解,他对草酸受热分解及其产物的检验做了探究: