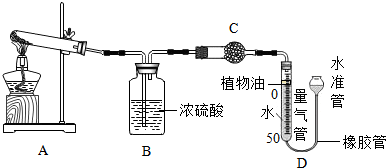
题目内容
3.有A、B、C三种物质各1.5克,发生了如下的化学反应:A+B+C→D,充分反应后生成3.0克的D.在残留物中再加入1.0克A,反应继续进行.待反应再次停止,反应物中仅剩余有C.以下结论正确的是( )| A. | 第一次反应停止时B剩余0.9克 | B. | 第一次反应停止时C剩余0.9克 | ||
| C. | 参加反应A与C的质量比是5:3 | D. | 第二次反应停止时C剩余0.9克 |
分析 第一次反应A不足,因为第一次反应后加入A又能进行第二次反应.第二次反应后,只剩余C,说明A、B恰好完全反应.则m反(A):m反(B)=(1.5g+1.0g):1.5g=5:3,据此计算第一次反应消耗B的质量,根据质量守恒计算消耗C的质量,进而计算反应中A与C的质量之比,根据A、C质量之比计算第二次反应消耗C的质量,进而计算第二次反应后剩余C的质量.
解答 解:第一次反应A不足,因为第一次反应后加入A又能进行第二次反应.第二次反应后,只剩余C,说明A、B恰好完全反应,则m反(A):m反(B)=(1.5g+1.0g):1.5g=5:3,
A.第一次反应耗B的质量为mB,则1.5g:mB=5:3,解得mB=0.9g,即第一次反应后剩余B质量为1.5g-0.9g=0.6g,故A错误;
B.根据mA+mB+mC=mD,可知生成3.0gD时消耗C的质量mC=3.0g-1.5g-0.9g=0.6g,故第一次反应后剩余C质量为1.5g-0.6g=0.9g,故B正确;
C.反应消耗A与C质量之比为mA:mC=1.5 g:0.6 g=5:2,故C错误;
D.反应消耗A、C质量之比mA:mC=5:2,故第二次反应中消耗C质量为:(1.5g+1.0g)×$\frac{2}{5}$=1.0g,故第二次反应后,C剩余质量为1.5g-1.0g=0.5 g,故D不正确,
故选B.
点评 本题考查化学方程式有关计算,涉及质量守恒定律运用,难度不大,注意对质量守恒定律的理解.

练习册系列答案
相关题目
7.为除去下列物质中的杂质(括号内是杂质),下列试剂选择和分离方法都正确的是( )
| 选项 | 物质(括号内为杂质) | 除杂试剂 | 分离方法 |
| A | 氯化钠固体(碳酸钠) | 稀盐酸 | 蒸发结晶 |
| B | 氢氧化钠溶液(氢氧化钙溶液) | 二氧化碳气体 | 过滤 |
| C | 氯化铜溶液(氯化锌) | 金属铜 | 过滤 |
| D | 氯化钠(氯化镁) | 过量氢氧化钠溶液 | 过滤、蒸发结晶 |
| A. | A | B. | B | C. | C | D. | D |
14.配制溶质质量分数为5%的下列溶液,能达到目的是( )
| A. | 称取5.0g氯化钾,溶解在95mL水中,充分搅拌 | |
| B. | 量取5.0mL过氧化氢溶液,放入入95mL水中,充分搅拌 | |
| C. | 量取5.0mL浓盐酸,倒入95mL水中,充分搅拌 | |
| D. | 称取5.0g碳酸钙,放入95mL水中,充分搅拌 |
8.观察如图,化石燃料在燃烧过程中会产生各种废气,其中形成酸雨的主要气体是( )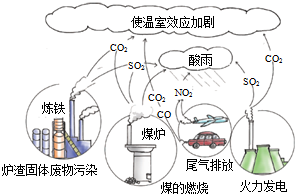

| A. | SO2、CO2 | B. | CO2、PM2.5 | C. | NO2、CO | D. | SO2、NO2 |