题目内容
14.通过海水提取的粗盐中含有MgCl2、CaCl2、MgSO4及泥沙等杂质.以下是一种制备精盐的实验方案(用于沉淀的试剂均过量).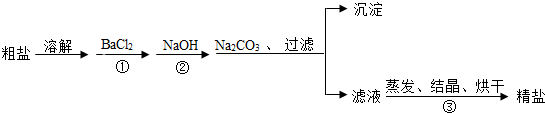
请回答下列问题:
(1)写出①或②中的反应方程式.
(2)加入BaCl2、NaOH、Na2CO3的顺序还可以改变吗?若能改变则写出改变的顺序,若不能改变,请说明理由.
(3)以上粗盐提纯的有关操作中需用到的主要仪器有哪些?(至少写出四种)
分析 (1)根据除杂质的方法考虑结合化学方程式的书写规则分析;
(2)碳酸钠可以将钙离子以及过量的钡离子沉淀下来;除镁离子用氢氧化钠,除钙离子用碳酸钠,除硫酸根离子用氯化钡,所加试剂要过量,为了将多余的杂质除掉,碳酸钠必须放在氯化钡的后面.
(3)根据粗盐提纯的步骤考虑.
解答 解:(1)加入BaCl2是为了与硫酸镁反应,化学方程式为BaCl2+MgSO4═BaSO4↓+MgCl2.
加入NaOH是为了除去氯化镁,化学方程式为MgCl2+2NaOH=Mg(OH)2↓+2NaCl,
(2)除杂试剂为了尽量除去杂质离子,一般是过量的,碳酸钠可以将钙离子以及过量的钡离子沉淀下来,BaCl2、NaOH、Na2CO3加入的顺序必须满足最后加入碳酸钠,过滤后再加盐酸至不再有气体生成即可,除杂试剂BaCl2、NaOH、Na2CO3加入的顺序还可以是NaOH、BaCl2、Na2CO3、(或BaCl2、Na2CO3、NaOH);
(3)粗盐提纯的步骤是溶解、过滤、蒸发;溶解时用到烧杯、玻璃棒,过滤时用到铁架台、漏斗、烧杯、玻璃棒,蒸发时用到铁架台、铁圈、蒸发皿、酒精灯、玻璃棒、坩埚钳、石棉网;
故答案为:(1)BaCl2+MgSO4═BaSO4↓+MgCl2;MgCl2+2NaOH=Mg(OH)2↓+2NaCl;(2)NaOH、BaCl2、Na2CO3、(或BaCl2、Na2CO3、NaOH);碳酸钠可以将钙离子以及过量的钡离子沉淀下来,BaCl2、NaOH、Na2CO3加入的顺序必须满足加入碳酸钠在氯化钡之后,
(3)烧杯、玻璃棒、漏斗、蒸发皿、酒精灯、铁架台、坩埚钳等.
点评 解答本题关键是要知道除杂质的方法,粗盐提纯的步骤和用到的仪器,为了能将杂质除净,应加入过量的试剂,要考虑过量的试剂应该如何除掉.

 阅读快车系列答案
阅读快车系列答案 在元素周期表中,硫元素的信息如图所示,下列从图中获得的信息不正确的是( )
在元素周期表中,硫元素的信息如图所示,下列从图中获得的信息不正确的是( )| A. | 在硫原子的核外电子排布中a=2和b=8 | |
| B. | 硫原子在化学反应中易获得2个电子生成S2- | |
| C. | 硫原子里,质子数=中子数=电子数=16 | |
| D. | 一个硫原子的相对原子质量是32.06克 |
 汞使用的历史很悠久,用途很广泛.在元素周期表中,汞元素的信息如图所示,对图中信息解释正确的是( )
汞使用的历史很悠久,用途很广泛.在元素周期表中,汞元素的信息如图所示,对图中信息解释正确的是( )| A. | 汞属于非金属元素 | |
| B. | 汞原子的相对原子质量是80 | |
| C. | 汞原子核外电子数是200.6 | |
| D. | 汞元素属于人体微量元素中的有害元素 |
| A. | 牛油、奶油 | B. | 米饭、土豆 | C. | 香蕉、桃子 | D. | 鸡蛋、牛奶 |
| A. | 用紫色石蕊试液可以区分氢氧化钠溶液和澄清石灰水 | |
| B. | 用观察颜色的方法可鉴别磷矿粉和硫酸铵 | |
| C. | 用适量BaCl2溶液可除去KNO3溶液中混有的K2SO4 | |
| D. | 配制一定溶质质量分数的稀硫酸时,应将水倒入浓硫酸中稀释 |
 (1)如图是甲、乙两物质的溶解度曲线,试回答:
(1)如图是甲、乙两物质的溶解度曲线,试回答: