题目内容
17.我国工业上以硫铁矿石为原料生产硫酸,所得矿渣可加工制得一种红色颜料-铁红,也可用于炼铁,生产流程如图所示: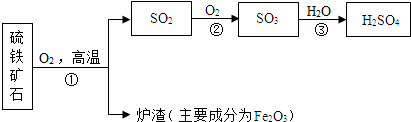
已知硫铁矿的主要成分是二硫化亚铁(FeS2),请回答下列问题:
(1)流程图所涉及的含硫物质中硫元素的最低价是-1价,属于氧化物的是SO2,SO3.
(2)反应①的化学方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2.
(3)若要生产纯度不低于98%的生铁100t,至少需要含杂质30%的矿渣200t.
(4)生产产生的尾气中,可能存在的大气污染物是SO2.下列物质能用于吸收该污染物的是②.
①稀硫酸 ②氢氧化钠溶液 ③澄清石灰水 ④无水硫酸铜.
分析 二氧化硫和三氧化硫都属于氧化物;
二硫化亚铁和氧气在高温条件下反应生成氧化铁和二氧化硫;
根据提供的数据可以进行相关方面的计算;
氢氧化钠能和二氧化硫反应生成亚硫酸钠和水.
解答 解:(1)流程图所涉及的含硫物质中硫元素的最低价是二硫化亚铁中硫元素的化合价,是-1价,属于氧化物的是SO2,SO3.
故填:-1;SO2,SO3.
(2)反应①的化学方程式为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2.
故填:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2.
(3)设至少需要含杂质30%的矿渣的质量为x,
根据题意有:x×(1-30%)×$\frac{112}{160}$×100%=100t×98%,
x=200t,
故填:200.
(4)生产产生的尾气中,可能存在的大气污染物是SO2;
下列物质能用于吸收该污染物的是氢氧化钠溶液.
故填:SO2;②.
点评 虽然澄清石灰水也能够吸收二氧化硫,但是由于氢氧化钙的溶解度很小,因此不能用于吸收二氧化硫.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
19.有人用下列方法除去硬水中某些可溶性钙、镁化合物,以降低水的硬度,你认为可行的方法是( )
| A. | 煮沸 | B. | 静置 | C. | 过滤 | D. | 加明矾 |
9.下列说法正确的是( )
| A. | 氧气占空气质量的21% | |
| B. | 好酒不怕巷子深,是由于分子的不断运动 | |
| C. | 催化剂在化学变化前后质量和性质保持不变 | |
| D. | 氧气可用于食品保鲜 |
6.守恒思想是以定量的角度观察化学世界的永恒主题.
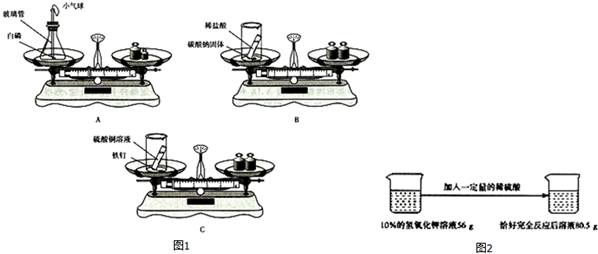
(1)用如图1所示的3个实验验证质量守恒定律,其中实验后天平不能保持平衡的是B(填序号),理由是装置未密闭,生成的二氧化碳气体逸出,导致左盘中容器内的物质总质量减少.
(2)卫星运载火箭的动力由高氯酸铵(NH4ClO4)发生反应提供,化学方程式为:
2NH4ClO4$\frac{\underline{\;高温\;}}{\;}$N2↑+C12↑+202↑+4X.则
①X的化学式为H2O.
②该反应属于基本反应类型中的分解反应.
(3)从微观角度分析有助于我们理解质量守恒定律.在一密闭容器内有四种物质A、B、C、D,它们在一定条件下发生化学反应.经过一段时间后停止反应,其中A、B、C、D的微观示意图和反应前后各物质的质量如下表所示.
①从微观角度分析,化学反应中质量守恒的原因是化学反应前后原子的种类不变,原子的数目不变,原子的质量不变.
②该反应中B和C的质量比为10:9.
③表中x的值是18.
(4)将0.8g草酸亚铁(FeC204)放在一个可称量的敞口容器中加热灼烧,固体质量随温度升高而变化的数据如下(下表中所注明的各温度下,容器中的固体均为纯净物):
①400℃时,容器中的固体为FeO(填化学式).
②400℃~500℃,发生了化合反应(填“分解反应”或“化合反应”).
③600℃~900℃,发生的反应可表示为6Fe2O3$\frac{\underline{\;高温\;}}{\;}$4Fe3O4+O2↑.
(5)根据图2的信息计算:
①加人的稀硫酸质量为24.5g.
②所用稀硫酸溶质的质量分数为20%.(化学方程式:2K0H+H2S04=K2S04+2H20)

(1)用如图1所示的3个实验验证质量守恒定律,其中实验后天平不能保持平衡的是B(填序号),理由是装置未密闭,生成的二氧化碳气体逸出,导致左盘中容器内的物质总质量减少.
(2)卫星运载火箭的动力由高氯酸铵(NH4ClO4)发生反应提供,化学方程式为:
2NH4ClO4$\frac{\underline{\;高温\;}}{\;}$N2↑+C12↑+202↑+4X.则
①X的化学式为H2O.
②该反应属于基本反应类型中的分解反应.
(3)从微观角度分析有助于我们理解质量守恒定律.在一密闭容器内有四种物质A、B、C、D,它们在一定条件下发生化学反应.经过一段时间后停止反应,其中A、B、C、D的微观示意图和反应前后各物质的质量如下表所示.
| 物质 | A | B | C | D |  氮原子 氮原子 氧原子 氧原子 氢原子 氢原子 |
| 微观示意图 |  |  |  |  | |
| 反应前质量/g | 100 | 20 | X | y | |
| 反应后质量/g | 32 | 140 | 126 | 46 |
②该反应中B和C的质量比为10:9.
③表中x的值是18.
(4)将0.8g草酸亚铁(FeC204)放在一个可称量的敞口容器中加热灼烧,固体质量随温度升高而变化的数据如下(下表中所注明的各温度下,容器中的固体均为纯净物):
| 温度(℃) | 25 | 350 | 400 | 500 | 600 | 900 |
| 固体质量(g) | 0.80 | 0.80 | 0.40 | 0.44 | 0.44 | 0.43 |
②400℃~500℃,发生了化合反应(填“分解反应”或“化合反应”).
③600℃~900℃,发生的反应可表示为6Fe2O3$\frac{\underline{\;高温\;}}{\;}$4Fe3O4+O2↑.
(5)根据图2的信息计算:
①加人的稀硫酸质量为24.5g.
②所用稀硫酸溶质的质量分数为20%.(化学方程式:2K0H+H2S04=K2S04+2H20)
 绘制实验装置图是我们初中生应该掌握的一项技能.图是某同学正在绘制的实验室用高锰酸钾制取氧气的装置图.请按要求回答下列问题.
绘制实验装置图是我们初中生应该掌握的一项技能.图是某同学正在绘制的实验室用高锰酸钾制取氧气的装置图.请按要求回答下列问题. 含有相同离子的盐也具有相似的化学性质
含有相同离子的盐也具有相似的化学性质