题目内容
13.甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答: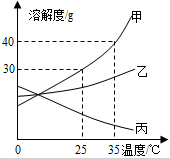
(1)35℃时,这三种物质溶解度由小到大的顺序为丙<乙<甲.
(2)若甲固体中含有少量乙,则提纯甲的方法是降温结晶.
(3)将25℃时乙的饱和溶液升温到35℃,则其溶液的溶质质量分数不变(填“变大”、“变小”或“不变”). 25℃时,将25g甲固体加入到50g水中,充分溶解并恢复到原温度后,得到溶液的质量为65g.
(4)35℃时,分别用等质量的甲、乙、丙配制该温度下的饱和溶液,所得溶液的质量最小的是甲.
分析 根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
解答 解:(1)通过分析溶解度曲线可知,35℃时,三种物质溶解度由小到大的顺序为:丙<乙<甲;
(2)甲物质的溶解度受温度变化影响较大,所以若甲固体中含有少量乙,提纯甲的方法是:降温结晶;
(3)乙物质的溶解度随温度的升高而增大,所以将25℃时乙的饱和溶液升温到35℃,其溶液的溶质质量分数不变,25℃时,甲物质的溶解度是30g,所以将25g甲固体加入到50g水中,充分溶解并恢复到原温度后,得到溶液的质量为65g;
(4)35℃时,甲物质的溶解度最大,所以分别用等质量的甲、乙、丙配制该温度下的饱和溶液,所得溶液的质量最小的是甲.
故答案为:(1)丙<乙<甲;
(2)降温结晶;
(3)不变,65;
(4)甲.
点评 本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.

练习册系列答案
相关题目
4.下列有关实验描述正确的是( )
| A. | 加热试管中的溶液时,拇指按在试管夹的短柄上 | |
| B. | 用胶头滴管吸取溶液时,在滴管伸入溶液前,要先捏紧胶头 | |
| C. | 稀盐酸中滴入紫色石蕊试液,溶液变红,说明酸遇指示剂变色 | |
| D. | 向一定量KOH和Ba(NO3)2混合溶液中逐滴滴加稀H2SO4,不会立即产生沉淀 |
8.下列各组中的离子,能在溶液中大量共存的是( )
| A. | K+ H+ SO42- OH- | B. | Na+ Ca2+ CO32- NO3- | ||
| C. | Na+ Cl- NO3- Ag+ | D. | Na+ Cu2+ Cl- SO42- |
18.随着生活节奏的加快,方便的小包装食品越来越受到人们的欢迎.为了防止富脂食品氧化变质和受潮,生产厂家往往在食品包装袋中放入有某些化学物质的小袋.你认为放在这些小袋中的物质应该是( )
| A. | 蔗糖 无水硫酸铜 | B. | 食盐 生石灰 | ||
| C. | 还原铁粉 生石灰 | D. | 烧碱 生石灰 |
3.某兴趣小组的同学为了测定碳酸钠样品(只含有氯化钠,不含其它杂质)中碳酸钠的含量,取该混合物样品与适量稀盐酸恰好完全反应,有关实验数据见附表.
附表:实验数据
(1)反应生成二氧化碳的质量为4.4g;
(2)反应后所得溶液的溶质质量分数是多少?(要有详细的计算过程)
附表:实验数据
| 反应前 | 反应后 | |||
| 实验数据 | 烧杯的质量/g | 稀盐酸的质量/g | 混合物样品的质量/g | 烧杯和其中混合物的质量/g |
| 40.6 | 123.4 | 12 | 171.6 | |
(2)反应后所得溶液的溶质质量分数是多少?(要有详细的计算过程)
