题目内容
14.根据下列实验装置图:“如图1”,回答有关问题.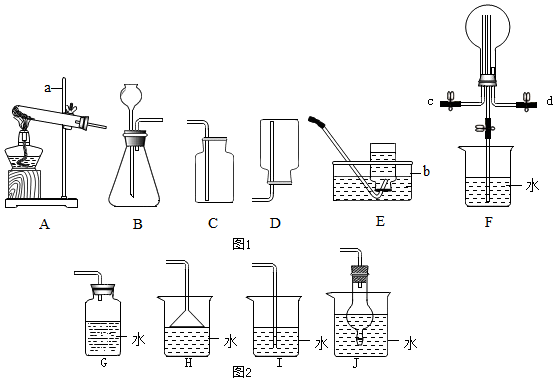
(1)写出图中标有仪器的名称:b水槽;
(2)实验室用加热氯酸钾和二氧化锰的混合物制取氧气的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,选择的发生装置是A(填字母,下同),若得到较纯净的氧气,选择的收集装置是E;
(3)氨气是无色、有强烈刺激性气味的气体,密度比空气小,极易溶于水.实验室常用加热氯化铵和熟石灰混合物制取氨气,制取氨气的装置组合是AD(填字母);
(4)某化学实验小组利用F装置收集氨气,并研究氨气的性质(部分仪器已略去)
①收集氨气时,氨气的进气口是c(填“c”或“d”).
②收集氨气后,进行探究氨气的性质实验,观察到烧瓶内产生了喷泉,说明氨气具有的性质是极易溶于水.
③如图2为防止环境污染,G~J装置可用于吸收多余氨气的是HJ(填序号).
分析 (1)根据常见仪器的名称进行分析;
(2)根据氯酸钾在二氧化锰的催化作用下,受热分解生成氯化钾和氧气、氧气的密度比空气的密度大,不易溶于水进行分析;
用双氧水和二氧化锰来制取氧气时不需要加热选用发生装置、过氧化氢在二氧化锰的催化作用下,分解生成水和氧气;
(3)根据制取氨气的反应物的状态和反应条件确定发生装置,根据氨气的密度和溶解性分析收集方法即可;
(4)①根据氨气的物理性质选择,氨气是比空气轻的极易溶于水的气体;
②氨气极易溶于水,可形成喷泉;
③选择的装置必须能够防止倒吸.
解答 解:(1)图中有标号仪器的名称:b是水槽.
故填:水槽.
(2)氯酸钾在二氧化锰的催化作用下,受热分解生成氯化钾和氧气;反应的化学方程式为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;用氯酸钾和二氧化锰混合加热制取氧气应该用A装置作为发生装置;因为氧气的密度比空气大,可以用向上排空气法收集,即用C装置收集;氧气不易溶于水,可以用排水法收集,即用E装置收集,用排水法收集的氧气比用排空气法收集的氧气纯净;
故填:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;A;E.
(3)实验室常用氯化铵固体与碱石灰固体共热来制取氨气.是加热固体制取气体,应选择的发生装置是A;由于氨气密度比空气小,氨气极易溶于水,只能用向下排空气法收集,收集装置可选用D.
故填:AD.
(4)①因为氨气的密度比空气小,收集氨气时,氨气的进气口是c.
②收集氨气一段时间后,打开F装置中的止水夹,观察到烧瓶内产生了喷泉,说明氨气具有的性质是氨气极易溶于水.
③为防止环境污染,要吸收掉多于的氨气,选择的装置必须能够防止倒吸,HJ装置中的倒置的漏斗和球形干燥管的体积较大,能防止液体倒吸进入反应装置,可用于吸收多余氨气.
故填:①c;②极易溶于水;③HJ.
点评 本道题主要考查了实验室制取气体发生装置和收集装置的选取,发生装置主要由反应物的状态和反应条件决定,收集装置主要由气体的密度和溶水性决定,另外还要考虑气体是否与水反应、是否与空气反应、是否有毒等等.

| A. |  将粗盐溶液倒入过滤装置进行过滤 | |
| B. |  使刚停止沸腾的水重新沸腾,向内打气 | |
| C. |  结晶时待水大部分蒸发,就停止加热 | |
| D. |  氧气收集完毕,先熄灭酒精灯,后将导管移出水面 |
| 反应时间/s | 20 | 40 | 60 | 80 | 100 |
| 烧杯和所盛药品质量/g | 137.8 | 135.6 | 134.5 | m | 134.5 |
(2)该石灰石样品中碳酸钙的质量分数(计算结果精确至0.1%).
| 温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
| 硝酸钾 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
| 氯化钠 | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
(2)请写出一种将硝酸钾的不饱和溶液转化为饱和溶液的方法加入硝酸钾(或蒸发溶剂、降低温度);
(3)20℃时,将20g 氯化钠放入50g水中,所得溶液的质量是68g;
(4)依上表分析,从氯化钠溶液中得到氯化钠晶体的最佳方法是蒸发结晶.






 某种胃药的止酸剂为碳酸钙,某课外活动小组为测定胃药中碳酸钙的质量分数,设计了以下几步实验操作(设药片中的其它成分不与盐酸反应):
某种胃药的止酸剂为碳酸钙,某课外活动小组为测定胃药中碳酸钙的质量分数,设计了以下几步实验操作(设药片中的其它成分不与盐酸反应):