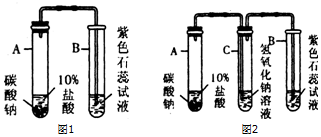
题目内容
13.为探究Zn、Fe、Cu、H的活动性,设计实验如下:
(1)为达到实验目的,可以省略的实验是C.(填字母序号)
(2)将C试管反应后的混合物过滤,向滤渣中加稀硫酸,有气泡产生,则滤液中的溶质为氯化亚铁.
(3)已知:4FeCl2+O2+4HCl=4FeCl3+2H2O,B试管中铁粉和过量的稀盐酸反应后,长期敞放在空气中,会观察到的现象是溶液由浅绿色变成黄色.
分析 铁和稀盐酸反应生成氯化亚铁和氢气;
氯化亚铁溶液是浅绿色溶液,氯化铁溶液是黄色溶液.
解答 解:(1)A中无明显现象,说明锌比铁活泼,B中产生气泡,溶液由无色变成浅绿色,说明铁和稀盐酸发生了反应,进一步说明铁比氢活泼,D中无明显现象,说明氢比铜活泼,由ABD可以判断锌比铁活泼,铁比氢活泼,氢比铜活泼,因此为达到实验目的,可以省略的实验是C.
故填:C.
(2)将C试管反应后的混合物过滤,向滤渣中加稀硫酸,有气泡产生,说明铁过量,则滤液中的溶质为氯化亚铁.
故填:氯化亚铁.
(3)B试管中铁粉和过量的稀盐酸反应后,长期敞放在空气中,氯化亚铁能被氧化成氯化铁,会观察到的现象是溶液由浅绿色变成黄色.
故填:溶液由浅绿色变成黄色.
点评 要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.

练习册系列答案
相关题目
15.下列离子能在pH=13的水溶液大量共存的是( )
| A. | SO42-、Cl-、Na+、H+ | B. | K+、SO42-、Cu2+、NO3- | ||
| C. | Cl-、K+、SO42-、Na+ | D. | Ca2+、Na+、CO32-、Cl- |
16.下列事实不能证明甲的金属活动性比乙强的是( )
| A. | 自然界中甲元素只以化合物形式存在,乙元素有单质形式存在 | |
| B. | 甲能与盐酸反应而乙不能 | |
| C. | 甲能从乙的盐溶液中置换出乙 | |
| D. | 化合物中甲元素显+2 价而乙元素显+3 价 |
2.下列各图所示的实验操作中,正确的( )
| A. |  检查装置的气密性 | B. |  点燃酒精灯 | ||
| C. |  制取氧气 | D. |  滴加溶液 |
3.目前,诺如病毒感染已经日趋严重,现在最有效的预防方法之一就是消毒液对空气消毒.84消毒液是含氯消毒液,主要成分为次氯酸钠,它能高效灭菌、无味.无毒、无腐化、无致敏反响,对诺如病毒的快速杀灭效果十分显著.已被广泛用于学校、机场等公共场所各类病毒沾染性的防疫.我校决定近期每天用次氯酸钠消毒液对全校教室、寝室全面消毒.小明观察到消毒液瓶上的标签如下表所示.
求:(1)这瓶1000毫升次氯酸钠消毒液的质量是1200克,其中含溶质次氯酸钠300克
(2)若将这种次氯酸钠消毒液500毫升与2400克水均匀混合,所得稀次氯酸钠消毒液中次氯酸钠的质量分数是多少?
(3)我校欲配制30千克质量分数为2%的稀次氯酸钠消毒液用来消毒,需要几瓶这样的消毒液?
| 消毒液1000毫升 | |
| 溶质的质量分数 | 25% |
| 密度 | 1.2克/厘米3 |
| 相对分子质量 | 74.5 |
| 腐蚀性;致敏性;游离氯可能引起中毒 | |
(2)若将这种次氯酸钠消毒液500毫升与2400克水均匀混合,所得稀次氯酸钠消毒液中次氯酸钠的质量分数是多少?
(3)我校欲配制30千克质量分数为2%的稀次氯酸钠消毒液用来消毒,需要几瓶这样的消毒液?