题目内容
10.硅及硅酸盐材料威海蓝星玻璃股份有限公司,是中国十大玻璃制造商之一,“蓝星玻璃”被评为“中国驰名商标”、“中国名牌”和“国家免检产品”等荣誉.他们正在以石英资源为基础,打造培育出威海市的龙头硅产业.石英砂的主要成分为二氧化硅,它是玻璃工业和陶瓷工业的原料,冶金工业的助熔剂.回答下列问题:
(1)“蓝星玻璃”由石英砂(SiO2)、纯碱、石灰石按一定的质量比混合,经高温烧制而成,其反应原理是(用化学方程式表示)CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑,Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑.
(2)在实验室里装有氢氧化钠溶液的试剂瓶不能用玻璃塞,原因是在常温下,NaOH与玻璃塞中的SiO2缓慢地发生反应生成Na2Si03和H2O,Na2Si03使瓶口与玻璃塞黏合在一起,则该反应的化学方程式为2NaOH+SiO2=Na2Si03+H2O.
(3)硅是太阳能电池和电脑芯片不可缺少的材料.生产高纯硅的流程示意图如下:

①由石英砂制备粗硅的反应中,同时有一氧化碳生成,该反应的化学方程式是Si02+2C$\frac{\underline{\;高温\;}}{\;}$Si+2C0↑.
②在整个制备过程中必须达到无水无氧,若在H2还原SiHCl3过程中混入02,可能引起的后果是硅被氧化而得不到高纯硅,并且发生爆炸.
③为了达到绿色化学和节约资源的目的,物质A需要循环使用,则A的化学式是HCl.
分析 (1)根据碳酸钙和二氧化硅在高温的条件下生成硅酸钙和二氧化碳,碳酸钠和二氧化硅在高温的条件下反应生成硅酸钠和二氧化碳进行分析;
(2)根据氢氧化钠和二氧化硅反应生成硅酸钠和水进行分析;
(3)①根据二氧化硅和碳在高温的条件下反应生成硅和一氧化碳进行分析;
②根据氢气与氧气可能爆炸,则整个制备过程必须达到无水无氧进行分析;
③根据生产高纯硅的流程示意图可知,盐酸既是反应物,又是生成物进行分析.
解答 解:(1)碳酸钙和二氧化硅在高温的条件下生成硅酸钙和二氧化碳,碳酸钠和二氧化硅在高温的条件下反应生成硅酸钠和二氧化碳,化学方程式为:CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑,Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑;
(2)氢氧化钠和二氧化硅反应生成硅酸钠和水,化学方程式为:2NaOH+SiO2=Na2Si03+H2O;
(3)①二氧化硅和碳在高温的条件下反应生成硅和一氧化碳,化学方程式为:Si02+2C$\frac{\underline{\;高温\;}}{\;}$Si+2C0↑;
②氢气与氧气可能爆炸,则整个制备过程必须达到无水无氧,所以在H2还原SiHCl3过程中混入02,可能引起的后果是:硅被氧化而得不到高纯硅,并且发生爆炸;
③由生产高纯硅的流程示意图可知,为了达到绿色化学和节约资源的目的,物质A需要循环使用,A的化学式是HCl.
故答案为:(1)CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑,Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑;
(2)2NaOH+SiO2=Na2Si03+H2O;
(3)①Si02+2C$\frac{\underline{\;高温\;}}{\;}$Si+2C0↑;
②硅被氧化而得不到高纯硅,并且发生爆炸;
③HCl.
点评 了解分子、原子、离子、元素与物质之间的关系;掌握氧化物的概念、反应类型的判定方法;掌握质量守恒定律的内容及其应用.

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案| 选项 | 物 质 | 所含杂质 | 除 去 杂 质 的 方 法 |
| A | Cu | CuO | 加入过量的稀硫酸、过滤、洗涤、干燥 |
| B | N2 | O2 | 放入足量的红磷后点燃 |
| C | NaCl溶液 | NaOH | 加入适量稀盐酸,蒸发、结晶 |
| D | FeSO4 | CuSO4 | 先加水溶解,再加足量金属铁,过滤,洗涤,干燥 |
| A. | A | B. | B | C. | C | D. | D |
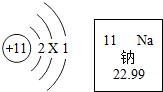 根据如图的有关信息判断,下列说法错误的是( )
根据如图的有关信息判断,下列说法错误的是( )| A. | 钠原子的核电荷数为11 | |
| B. | 钠的原子结构示意图中X=8 | |
| C. | 钠原子的相对原子质量为22.99 | |
| D. | 在化学反应中,钠原子容易得到1个电子 |
| 实验次数 | 稀盐酸用量(g) | 生成二氧化碳的质量(g) |
| 1 | 10 | 1.1 |
| 2 | 10 | 2.2 |
| 3 | 10 | 3.3 |
| 4 | 10 | 4.4 |
| 5 | 10 | 4.4 |
(1)在第四次实验中,碳酸钠完全反应.
(2)求所取样品中碳酸钠的质量分数(计算结果保留一位小数).
| A组 | B组 | C组 | D组 | 待分类组 |
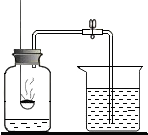 测定空气里氧气的含量 测定空气里氧气的含量 | 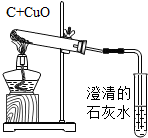 木炭还原氧化铜 木炭还原氧化铜 | 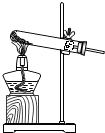 高锰酸钾制氧气 高锰酸钾制氧气 | 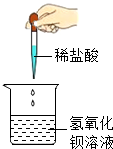 酸碱中和反应 酸碱中和反应 |  铁与硫酸铜溶液反应 铁与硫酸铜溶液反应 |

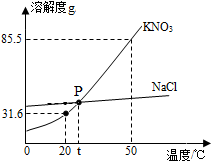 如图为NaCl和KNO3的溶解度曲线,请回答下列问题:
如图为NaCl和KNO3的溶解度曲线,请回答下列问题: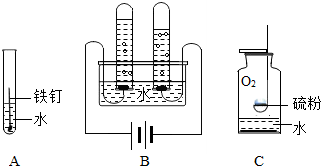 水是生命的源泉,下列变化都是与水相关,请根据A、B、C、D图示回答下列问题:
水是生命的源泉,下列变化都是与水相关,请根据A、B、C、D图示回答下列问题: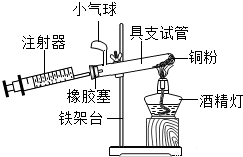 为测定空气中氧气的含量,小华同学打算设计如下方案:选用实际容积为50mL的具支试管作反应容器,将过量的铜粉放入试管,用橡皮塞塞紧具支试管,通过导管与实际容积为60mL且润滑性很好的针筒注射器组成如图的实验装置.请回答下列问题:
为测定空气中氧气的含量,小华同学打算设计如下方案:选用实际容积为50mL的具支试管作反应容器,将过量的铜粉放入试管,用橡皮塞塞紧具支试管,通过导管与实际容积为60mL且润滑性很好的针筒注射器组成如图的实验装置.请回答下列问题: