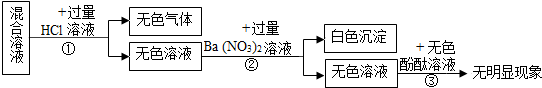
题目内容
15.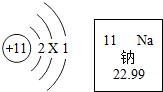 根据如图的有关信息判断,下列说法错误的是( )
根据如图的有关信息判断,下列说法错误的是( )| A. | 钠原子的核电荷数为11 | |
| B. | 钠的原子结构示意图中X=8 | |
| C. | 钠原子的相对原子质量为22.99 | |
| D. | 在化学反应中,钠原子容易得到1个电子 |
分析 原子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层.若最外层电子数≥4,则一般为非金属元素,在化学反应中易得电子,若最外层电子数<4,则一般为金属元素,在化学反应中易失去电子.
根据图中元素周期表可以获得的信息:左上角的数字表示原子序数;字母表示该元素的元素符号;中间的汉字表示元素名称;汉字下面的数字表示相对原子质量,进行分析判断即可.
解答 解:A、根据元素周期表中的一格中获取的信息,钠元素的原子序数为11,根据原子序数=核电荷数=质子数,则钠元素的核电荷数为11,故选项说法正确.
B、原子中质子数=核外电子数,则11=2+X+1,X=8,故选项说法正确.
C、由钠元素元素周期表中的一格中获取的信息,钠原子的相对原子质量为22.99,故选项说法正确.
D、钠原子的最外层电子数是1,在化学反应中易失去1个电子而形成阳离子,故选项说法错误.
故选:D.
点评 本题难度不大,掌握原子结构示意图及其意义、元素周期表中元素的信息是正确解答本题的关键.

练习册系列答案
相关题目
16.下列应用及相应原理(用化学方程式表示)及基本反应类型都正确的是( )
| A. | 用木炭测空气中氧气含量C+02$\frac{\underline{\;点燃\;}}{\;}$C02化合反应 | |
| B. | 高炉炼铁中发生的主要反应2Fe203+3C$\frac{\underline{\;高温\;}}{\;}$4Fe+3C02↑ 置换反应 | |
| C. | 用稀盐酸除铁锈 Fe203+6HCI=2FeCl3+3H20 复分解反应 | |
| D. | 实验室制二氧化碳 CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ 分解反应 |
17.氢氧化钠是一种重要的化工原料,广泛应用于玻璃、造纸等行业,其俗称是( )
| A. | 纯碱 | B. | 小苏打 | C. | 消石灰 | D. | 烧碱 |
7.生产电脑芯片的材料主要是高纯硅,工业生产硅的原理为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,在反应中发生了还原反应的是( )
| A. | C | B. | SiO2 | C. | Si | D. | CO |
4.下列变化属于物理变化的是( )
| A. | 纸张燃烧 | B. | 铜表面生成铜绿 | ||
| C. | 高炉炼铁 | D. | 从石油中分离出汽油 |