题目内容
3.图1是甲、乙、丙三种固体物质溶解度曲线.
(1)乙是(填“易”、“可”、“微”、“难”)易溶物质;
(2)将40℃时甲、乙、丙三种物质的饱和溶液降温到10℃后,则三种溶液溶质的质量分数由大到小的顺序是乙>甲>丙;
(3)如图2所示,20℃时,把盛有X的饱和溶液的试管放入盛有水的烧杯中,在烧杯中加入适量氢氧化钠固体,一段时间后,发现试管中有晶体析出,则X可能为甲、乙、丙三种固体物质中的丙(填“甲”、“乙”、|“丙”);
(4)乙中混有少量的甲,可以用蒸发结晶的方法提纯乙.
分析 (1)室温(20℃)时,溶解度大于10克的属于易溶物质,在1克和10克之间是可溶物质,在0.01克和1克之间属于微溶物质,小于0.01克的是不溶物质;
(2)饱和溶液中溶质的质量分数=$\frac{溶解度}{溶解度+100g}$×100%,即溶解度大则溶质的质量分数大,结合物质的溶解度随温度变化情况分析解答;
(3)氢氧化钠固体溶于水放热,使溶液的温度升高,试管中有晶体析出,说明物质的溶解度随温度升高而减小,结合溶解度曲线分析即可;
(4)乙的溶解度受温度影响不大,甲的溶解度随温度而增大,且变化较大,所以可用蒸发结晶的方法提纯乙.
解答 解:(1)室温(20℃)时,乙的溶解度大于20克,所以属于易溶物质;
(2)若将40℃三种物质的饱和溶液分别降温到10℃时,甲乙溶解度减小,析出晶体,依然是饱和溶液,丙溶解度变大,变为不饱和溶液,溶质质量分数与降温前相等;饱和溶液中溶质的质量分数=$\frac{溶解度}{溶解度+100g}$×100%,即溶解度大则溶质的质量分数大,而10℃时乙的溶解度大于甲的溶解度大于40℃时丙的溶解度,则三种溶液中溶质的质量分数由大到小的顺序是乙>甲>丙;
(3)氢氧化钠固体溶于水放热,使溶液的温度升高,试管中有晶体析出,说明物质的溶解度随温度升高而减小,结合溶解度曲线可知丙的溶解度随温度升高而减小,则X可能是丙;
(4)乙的溶解度受温度影响不大,甲的溶解度随温度而增大,且变化较大,所以可用蒸发结晶的方法提纯乙;
故答案为:(1)易; (2)乙>甲>丙; (3)丙; (4)蒸发.
点评 了解物质的溶解性和溶解度的关系、饱和溶液中溶解度大则溶质的质量分数等知识,并能据物质的溶解度随温度变化分析提纯物质的方法.

练习册系列答案
相关题目
11.向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入一定质量的锌粉,充分反应后过滤,滤液为蓝色.根据上述实验现象分析判断,下列说法中,不正确的是( )
| A. | 滤液中一定存在Zn(NO3)2 | B. | 滤液中可能存在Ag+ | ||
| C. | 滤渣中一定含有单质Ag | D. | 滤渣中一定含有单质Cu |
8.下表列出了除去物质中所含少量杂质的方法,其中错误的是( )
| 物质 | 所含杂质 | 除去杂质的方法 | |
| A | CaO | CaCO3 | 加入足量的水溶解、过滤 |
| B | NaOH溶液 | Na2CO3 | 加入过量的Ca(OH)2溶液,过滤 |
| C | Cu(NO3)2溶液 | AgNO3 | 加入过量的铜粉,过滤 |
| D | CO | CO2 | 通过NaOH浓溶液,干燥 |
| A. | A | B. | B | C. | C | D. | D |
15. 组装如图所示装置,向盛水的试管中加入某种物质后,用玻璃管连接的气球胀大的是( )
组装如图所示装置,向盛水的试管中加入某种物质后,用玻璃管连接的气球胀大的是( )
 组装如图所示装置,向盛水的试管中加入某种物质后,用玻璃管连接的气球胀大的是( )
组装如图所示装置,向盛水的试管中加入某种物质后,用玻璃管连接的气球胀大的是( )| A. | 氢氧化钠 | B. | 生石灰 | C. | 食盐 | D. | 硝酸铵 |
12.香椿树的嫩芽香椿被称为“树上蔬菜”,香椿不仅营养丰富,还含有的皂甙具有抗菌、防癌的药用价值.下列有关皂甙(化学式为C27H42O3)说法中错误的是( )
| A. | 皂甙属于有机物 | B. | 一个皂甙分子中含有72个原子 | ||
| C. | 皂甙由三种元素组成 | D. | 皂甙中氢、氧元素质量为14:1 |

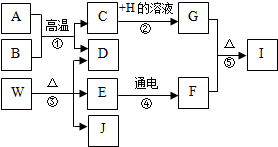 A~J分别为初中化学常见物质,他们的转换关系如图所示.已知A为铁锈的主要成分,E在常温下为无色液体,H的溶液呈蓝色,I是黑色固体,常温下B、D、F均为无色气体,其中B是有毒气体,J在工业上常用于玻璃、造纸、纺织和洗涤剂的生产等.(反应②④的个别生成物已略去)
A~J分别为初中化学常见物质,他们的转换关系如图所示.已知A为铁锈的主要成分,E在常温下为无色液体,H的溶液呈蓝色,I是黑色固体,常温下B、D、F均为无色气体,其中B是有毒气体,J在工业上常用于玻璃、造纸、纺织和洗涤剂的生产等.(反应②④的个别生成物已略去)