题目内容
为了测定一份铁镁合金混合粉末中铁的质量分数,某校化学兴趣小组取该样品8g分四次加入盛有100g未知浓度的硫酸溶液的烧杯(已知烧杯质量为50g)中,充分反应后,测得烧杯和烧杯内物质的质量数据记录如下:

(1)表中第三次加入混合粉末后,烧杯和烧杯内溶液的总质量是 g;
(2)所用硫酸溶液的溶质质量分数是 ;
(3)混合粉末中铁的质量分数是 。
【答案】(1)157.7 (2)14.7% (3)96.25%
【解析】(1)由表格数据可知,每增加2g样品,烧杯内总质量增加1.9g,所以表中第三次加入混合粉末后,烧杯和烧杯内溶液的总质量是153.8g+1.9g=157.7g;
(2)根据质量守恒定律,知反应后烧杯内溶液总质量减少了(100g+50g+8g)-157.7g==0.3g,这就是生成氢气的质量,因为氢气都是来自稀硫酸,所以设稀硫酸中溶质的质量为x,则
H2SO4~H2
98 2
x 0.3g
 x==14.7g ,
x==14.7g ,
所以所用硫酸溶液的溶质质量分数是 。
。
(3)设混合粉末中铁的质量为y,则混合粉末中镁的质量为8g-y
Fe+H2SO4═FeSO4+H2↑
56 2
y 
同理:Mg+ H2SO4=MgSO4+H2↑
24 2
8g-y 
所以 +
+ =0.3g
=0.3g
解之得 y=7.7g,混合粉末中铁的质量分数是 。
。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案将4.0g Cu—Zn合金粉末放到盛有10g稀硫酸的烧杯中,恰好完全反应。过滤,称量滤液的质量,相关实验数据如下:
| 反应前物质质量/g | 反应后物质质量/g | |
| Cu—Zn合金 | 稀硫酸 | 滤液质量 |
| 4.0 | 10 | 11.26 |
⑴Cu—Zn合金属于 材料(填“金属”或“有机合成”)。
⑵若不考虑该合金中除Cu、Zn以外的其它成分,请计算原Cu—Zn合金中Zn的质量。写出必要的计算过程。(Zn-65 Cu-63.5 H-1 O-16 S-32)
某氢氧化钙中含碳酸钙杂质。称取研细的该样品12.4g放入锥形瓶中,加入32.6g的水,充分振荡形成悬浊液,再向锥形瓶中逐滴滴加盐酸使其充分反应至无气泡产生。测得加入盐酸的质量与锥形瓶中的物质的质量关系如下表示。
| 加入盐酸的质量g | 0 | 25 | 37.5 |
| 锥形瓶中物质的质量 | 45 | 70 | 80.3 |
(1)加入盐酸的质量在0—25g时, 与盐酸发生反应。
(2)反应产生二氧化碳质量为 g。
(3)求样品中氢氧化钙的质量分数(写出计算过程,精确到0.1%)。
 。请计算:
。请计算: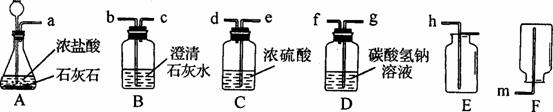 ①A中反应的化学方程式为___________________________________________________。
①A中反应的化学方程式为___________________________________________________。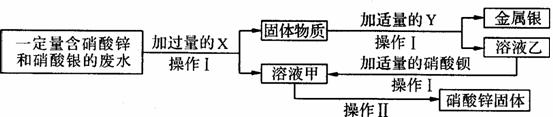 ①X为____;乙与硝酸钡反应的化学方程式为_____________________________________。
①X为____;乙与硝酸钡反应的化学方程式为_____________________________________。