题目内容
7.某小组在探究铁、铜、镁、银四种金属的活动性顺序时,做了图1所示的三个实验(所用金属的形状与大小、稀盐酸的质量分数和用量均相同).
(1)通过Ⅰ和Ⅱ可比较镁和铁的金属活动性强弱,依据的实验现象是什么?
(2)小燕认为图1三个实验不能得出四种金属的活动性顺序,原因是什么?
(3)探究小组在图1实验的基础上,补充一个实验(图2),实现了探究目的.则X、Y分别是什么?
分析 镁比铁活泼,铁比铜活泼,铜比银活泼;
金属越活泼,和酸的反应速率越快.
解答 解:(1)通过Ⅰ和Ⅱ可比较镁和铁的金属活动性强弱,依据的实验现象是:镁片表面产生气泡的速率比铁片表面产生气泡的速率快.
故答案为:镁片表面产生气泡的速率比铁片表面产生气泡的速率快.
(2)小燕认为图1三个实验不能得出四种金属的活动性顺序,原因是:通过Ⅰ和Ⅱ说明镁比铁活泼,通过Ⅲ说明铜比银活泼,但是不能判断铁和铜的活泼性.
故答案为:通过Ⅰ和Ⅱ说明镁比铁活泼,通过Ⅲ说明铜比银活泼,但是不能判断铁和铜的活泼性.
(3)补充的实验可以是把铁片放入硫酸铜溶液中,铁片表面附着一层红色固体,说明铁比铜活泼,进一步可以判断出镁比铁活泼,铁比铜活泼,铜比银活泼,因此X、Y可以分别是铁片和硫酸铜溶液.
故答案为:铁片和硫酸铜溶液.
点评 要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.如图是某学生对“MnO2催化H2O2分解实验装置的创新设计”,当实验过程中将装置竖立后,棒香立即燃烧.关于棒香能燃烧的原因.下列说法错误的是( )


| A. | 棒香的巷火点降低了 | B. | 有充足的氧气 | ||
| C. | 温度达到着火点 | D. | 棒香是可燃物 |
2.小明学完金属活动性顺序后,想探究铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,因此进行了如下探究活动:
【查阅资料】铬(Cr)是银白色有光泽的金属,在空气中,其表面能生成抗腐蚀的致密氧化膜.铬能与稀硫酸反应,生成氢气和+2价的硫酸盐.
【提出猜想】对这三种金属的活动性顺序提出了如下猜想:
猜想一:Cr>Al>Cu 猜想二:Cr>Cu>Al
猜想三:Al>Cr>Cu 猜想四:Al>Cu>Cr
【讨论交流】根据已学的金属活动性顺序和已查阅的资料分析,肯定不能成立的是猜想二和猜想四.
【实验探究】请将表中的内容填写完整.
【实验反思】将金属片投入稀硫酸前要先打磨的目的是除去金属表面的氧化物.判断几种金属的活动性顺序,可以依据金属与酸是否反应放出氢气的快慢来判断,或根据金属与盐溶液之间的反应来判断.
【查阅资料】铬(Cr)是银白色有光泽的金属,在空气中,其表面能生成抗腐蚀的致密氧化膜.铬能与稀硫酸反应,生成氢气和+2价的硫酸盐.
【提出猜想】对这三种金属的活动性顺序提出了如下猜想:
猜想一:Cr>Al>Cu 猜想二:Cr>Cu>Al
猜想三:Al>Cr>Cu 猜想四:Al>Cu>Cr
【讨论交流】根据已学的金属活动性顺序和已查阅的资料分析,肯定不能成立的是猜想二和猜想四.
【实验探究】请将表中的内容填写完整.
| 实验操作 | 实验现象 | 实验结论 |
| 将大小相同并打磨光亮的铬片、铝片、铜片分别放入盛有体积相同、质量分数相同的稀硫酸的试管中. | 铬片表面产生气泡较慢, 铝片表面产生气泡较快,铜片表面无明显现象 | 猜想三成立,铬与稀硫酸反应的化学方程式为Cr+H2SO4═CrSO4+H2↑ |
12.20℃时,取甲、乙、丙、丁四种纯净物各20克,分别加入到四个各盛有50克水的烧杯中,充分溶解,其溶解情况如下表:
下列说法正确的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 未溶解固体的质量/克 | 4.2 | 2 | 0 | 9.2 |
| A. | 所得四杯溶液都是饱和溶液 | |
| B. | 丁溶液的溶质质量分数最大 | |
| C. | 四杯溶液中溶剂质量大小为:丙>乙>甲>丁 | |
| D. | 20℃时四种物质溶解度大小为:丙>乙>甲>丁 |
19. 小亮发现:收集的氧气占集气瓶容积的60%(空气占40%)时,能使带火星的木条复燃.那么,使带火星的木条复燃的氧气浓度的最低值是多少呢?小亮对此展开探究:
小亮发现:收集的氧气占集气瓶容积的60%(空气占40%)时,能使带火星的木条复燃.那么,使带火星的木条复燃的氧气浓度的最低值是多少呢?小亮对此展开探究:
第一组实验:取5只集气瓶,编号为①、②、③、④、⑤,分别装入其总容积10%、20%、30%、40%、50%的水.用排水法收集氧气,恰好把5只集气瓶中的水排去.将带火星的木条依次插入①~⑤号瓶中,记录实验现象.
小亮在前一组实验的基础上又做了第二组和第三组实验,三组实验的数据和现象见下表.
请根据实验回答下列问题:
(1)写出实验室加热高锰酸钾制取氧气的化学方程式2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(2)收集的氧气占容积的体积分数最低为35%时,可使带火星的木条复燃,这时集气瓶中氧气分数是48或49%(计算结果保留整数).
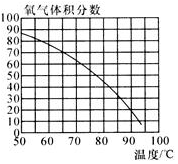
(3)此时混合气体中氧气的体积分数随温度变化的曲线如图所示.若只考虑氧气的体积分数对实验结果的影响,欲使带火星的木条复燃,应将加热双氧水的最高温度控制在82℃.
(4)采取“半值法”探究能减少实验次数.例如:第一组实验若按③、④的编号顺序进行实验,即可确定下一组实验收集的氧气占容积的体积分数应在30%~40%之间,从而省去编号为①、②、⑤的实验,同理,第二组实验可以省去的实验编号为①④⑤.
 小亮发现:收集的氧气占集气瓶容积的60%(空气占40%)时,能使带火星的木条复燃.那么,使带火星的木条复燃的氧气浓度的最低值是多少呢?小亮对此展开探究:
小亮发现:收集的氧气占集气瓶容积的60%(空气占40%)时,能使带火星的木条复燃.那么,使带火星的木条复燃的氧气浓度的最低值是多少呢?小亮对此展开探究:第一组实验:取5只集气瓶,编号为①、②、③、④、⑤,分别装入其总容积10%、20%、30%、40%、50%的水.用排水法收集氧气,恰好把5只集气瓶中的水排去.将带火星的木条依次插入①~⑤号瓶中,记录实验现象.
小亮在前一组实验的基础上又做了第二组和第三组实验,三组实验的数据和现象见下表.
| 第一组 | 第二组 | 第第三组 | |||||||||
| 集气瓶编号 | ① | ② | ③ | ④ | ⑤ | ① | ② | ③ | ④ | ⑤ | ① |
| 收集的O2占容积的体积分数(%) | l0 | 20 | 30 | 40 | 50 | 3l | 33 | 35 | 37 | 39 | 34 |
| 带火星木条的状况 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 | 很亮 | 很亮 | 复燃 | 复燃 | 复燃 | 很亮 |
(1)写出实验室加热高锰酸钾制取氧气的化学方程式2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(2)收集的氧气占容积的体积分数最低为35%时,可使带火星的木条复燃,这时集气瓶中氧气分数是48或49%(计算结果保留整数).
(3)此时混合气体中氧气的体积分数随温度变化的曲线如图所示.若只考虑氧气的体积分数对实验结果的影响,欲使带火星的木条复燃,应将加热双氧水的最高温度控制在82℃.
(4)采取“半值法”探究能减少实验次数.例如:第一组实验若按③、④的编号顺序进行实验,即可确定下一组实验收集的氧气占容积的体积分数应在30%~40%之间,从而省去编号为①、②、⑤的实验,同理,第二组实验可以省去的实验编号为①④⑤.
 B. 滴加液体
B. 滴加液体
 D. 读取液体体积
D. 读取液体体积
 实验室用图1气体发生装置来制取二氧化碳,老师给小李提供了石灰石、无标签的稀盐酸和稀硫酸水溶液各一瓶.
实验室用图1气体发生装置来制取二氧化碳,老师给小李提供了石灰石、无标签的稀盐酸和稀硫酸水溶液各一瓶.