题目内容
4.R电缆厂是一家以生产电缆类产品为主的企业,在电缆生产过程中,不可避免会产生一定量的含铜废料(如:零碎电缆).某化学兴趣小组的同学得知这一情况后,围绕“从含铜废料中回收铜”提出了各自的看法.
甲同学根据已学知识,提出了一套回收方案(图1),铜可与浓硫酸在溶液中发生反应(方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑);
乙同学在查阅资料后得知:在通入空气并加热的务件下,铜可与稀硫酸在溶液中发生反应(方程式为:2Cu+2H2SO4+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O),于是他提出了另一套方案(图2):
(1)乙方案在滤液中加入铁屑的步骤中,涉及的化学反应方程式是Fe+CuSO4═FeSO4+Cu、Fe+H2SO4═FeSO4+H2↑;
(2)从环保角度对两套方案的不同部分进行比较,你认为甲(选填“甲”或“乙”)的方案不合理.理由是:铜和浓硫酸反应生成污染环境的气体二氧化硫.
(3)无论是甲或乙的方案,加入略过量的铁屑的目的是使硫酸铜中的铜完全置换出来.如果铁过量,该用什么化学方法去除红色粉末中的铁加入适量的稀盐酸,充分反应后过滤.
(4)最后,老师肯定了同学们的积极思考,但同时指出:方案最后一步所得浅绿色滤液结晶后,会得到一种俗称“绿矾”的工业产品,可增加经济效益.请写出使绿矾结晶的方法:降温结晶.(“绿矾”的溶解度随温度升高而增大).
分析 (1)乙方案在滤液中加入铁屑的步骤中,铁能和硫酸铜反应生成硫酸亚铁和铜,过量的稀硫酸能和铁反应生成硫酸亚铁和氢气;
(2)二氧化硫有毒,扩散到空气中会污染环境;
(3)铜不能和稀盐酸反应,铁能和稀盐酸反应生成氯化亚铁和氢气;
(4)对于溶解度随温度升高而增大的物质来说,降低溶液温度到一定程度时会析出晶体.
解答 解:(1)乙方案在滤液中加入铁屑的步骤中,铁能和硫酸铜反应生成硫酸亚铁和铜,过量的稀硫酸能和铁反应生成硫酸亚铁和氢气,反应的化学方程式为:Fe+CuSO4═FeSO4+Cu,Fe+H2SO4═FeSO4+H2↑.
故填:Fe+CuSO4═FeSO4+Cu;Fe+H2SO4═FeSO4+H2↑.
(2)从环保角度对两套方案的不同部分进行比较,甲的方案不合理.理由是:铜和浓硫酸反应生成污染环境的气体二氧化硫.
故填:甲;铜和浓硫酸反应生成污染环境的气体二氧化硫.
(3)无论是甲或乙的方案,加入略过量的铁屑的目的是使硫酸铜中的铜完全置换出来;
如果铁过量,除红色粉末中的铁的方法是:加入适量的稀盐酸,充分反应后过滤.
故填:使硫酸铜中的铜完全置换出来;加入适量的稀盐酸,充分反应后过滤.
(4)因为“绿矾”的溶解度随温度升高而增大,因此降低硫酸亚铁溶液的温度能够使绿矾结晶.
故填:降温结晶.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
相关题目
14.下列有关金属用途的说法,错误的是( )
| A. | 用钨制灯丝 | B. | 用铝制高压电线 | ||
| C. | 用纯铁制铁轨 | D. | 用不锈钢制医疗器械 |
15.在日常生活和工农业生产中,溶液有着广泛的应用.比如,氨碱工业用到的是饱和食盐水,医疗上使用的则是0.9%的生理盐水.请按要求设计并完成以下实验:
实验用品:氯化钠溶液、氯化钠、硝酸钾、蒸馏水、烧杯、试管、玻璃棒、药匙.
探究实验一:澄清透明的氯化钠溶液是否是饱和溶液
探究实验二:将不饱和氯化钠溶液变为饱和溶液并探究饱和氯化钠溶液还能否溶解硝酸钾
实验用品:氯化钠溶液、氯化钠、硝酸钾、蒸馏水、烧杯、试管、玻璃棒、药匙.
探究实验一:澄清透明的氯化钠溶液是否是饱和溶液
| 实验步骤 | 实验现象 | 实验结论 |
| 取一只试管倒入约5mL氯化钠溶液,用药匙加入少量氯化钠固体,振荡,观察现象. | 氯化钠固体溶解 | 是不饱和氯化钠溶液 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取一只试管倒入约10mL不饱和氯化钠溶液,用药匙加入适量氯化钠固体,振荡 | 氯化钠不能再溶解 | NaCl不饱和溶液变为饱和溶液 |
| 取一只试管倒入约10mL饱和氯化钠溶液,用药匙加入适量硝酸钾固体,振荡 | 硝酸钾溶解 | 饱和氯化钠溶液能够溶解硝酸钾 |
12.实验室经常会用到不同的仪器,其材料可分为不同物质类别,以下分类不正确的是( )
| A. | 制造药匙的不锈钢属于混合物 | |
| B. | 制造蒸发皿的陶瓷主要成分是硅酸鈣(CaSiO3),硅酸钙属于盐 | |
| C. | 制造棕色试剂瓶的玻璃,其主要成分为二氧化硅,玻璃属于化合物 | |
| D. | 火柴头覆盖的红色物质为红磷,红磷属于单质 |
19. 无水硫酸铜是白色固体,遇水变蓝,某气体可能含有水蒸气、CO、H2中的一种或几种,为确定成分,最佳的实验方案是将气体依次通入装置( )
无水硫酸铜是白色固体,遇水变蓝,某气体可能含有水蒸气、CO、H2中的一种或几种,为确定成分,最佳的实验方案是将气体依次通入装置( )
 无水硫酸铜是白色固体,遇水变蓝,某气体可能含有水蒸气、CO、H2中的一种或几种,为确定成分,最佳的实验方案是将气体依次通入装置( )
无水硫酸铜是白色固体,遇水变蓝,某气体可能含有水蒸气、CO、H2中的一种或几种,为确定成分,最佳的实验方案是将气体依次通入装置( )| A. | 丙、甲.丙、乙 | B. | 丙、乙、甲、乙 | C. | 丙、甲、乙、丙 | D. | 甲、乙、丙、甲 |
9.小明选择“铝丝和盐酸反应的快慢与什么因素有关”的课题开展探究.如表是他分别用相同质量的铝丝和足量稀盐酸反应的三组实验数据:
(1)写出铝和盐酸反应的化学方程式:2Al+6HCl=2AlCl3+3H2↑.
(2)能表明盐酸浓度对反应快慢有影响的实验编号是:①和②.
(3)如果把实验①中盐酸的质量分数改为4.5%,请你推出铝丝消失时间(用t表示)的取值范围:300<t<500.
(4)除了用铝丝消失的时间,请你再想一个方法来衡量该反应的快慢:用排水法收集一瓶氢气所需时间的多少来衡量(或通过单位时间内生成氢气的量、温度变化来衡量等,其他合理答案均可).
| 试验编号 | 盐酸的质量分数/% | 反应温度 | 铝丝消失时间/s |
| ① | 3 | 20 | 500 |
| ② | 6 | 20 | 300 |
| ③ | 6 | 30 | 80 |
(2)能表明盐酸浓度对反应快慢有影响的实验编号是:①和②.
(3)如果把实验①中盐酸的质量分数改为4.5%,请你推出铝丝消失时间(用t表示)的取值范围:300<t<500.
(4)除了用铝丝消失的时间,请你再想一个方法来衡量该反应的快慢:用排水法收集一瓶氢气所需时间的多少来衡量(或通过单位时间内生成氢气的量、温度变化来衡量等,其他合理答案均可).
 金属是重要的资源,在日常生活中已得到越来越广泛的应用.
金属是重要的资源,在日常生活中已得到越来越广泛的应用.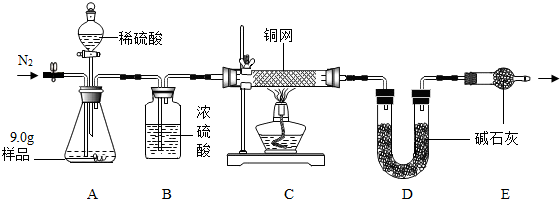
 科学严谨的态度,安全规范的操作是成功进行化学实验的保障.
科学严谨的态度,安全规范的操作是成功进行化学实验的保障.