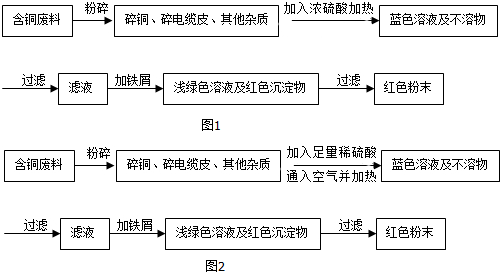
题目内容
19. 无水硫酸铜是白色固体,遇水变蓝,某气体可能含有水蒸气、CO、H2中的一种或几种,为确定成分,最佳的实验方案是将气体依次通入装置( )
无水硫酸铜是白色固体,遇水变蓝,某气体可能含有水蒸气、CO、H2中的一种或几种,为确定成分,最佳的实验方案是将气体依次通入装置( )| A. | 丙、甲.丙、乙 | B. | 丙、乙、甲、乙 | C. | 丙、甲、乙、丙 | D. | 甲、乙、丙、甲 |
分析 首先分析气体的性质及各装置的作用,一氧化碳和氢气具有还原性,可通过灼热的氧化铜,并检验其生成物分析气体的成分;二氧化碳能使澄清的石灰水变浑浊,乙是用来检验二氧化碳,丙中的无水硫酸铜遇水会由白色变为蓝色,可用来检验气体中是否含有水蒸气;还要注意验证气体一定要排除干扰性气体的存在;进行分析判断.
解答 解:一氧化碳和氢气具有还原性,可通过灼热的氧化铜,分别生成铜和二氧化碳、铜和水蒸气.
由于气体从水溶液中出来的时候都带有水蒸气,为了排除干扰,首先应将气体通过丙检验是原气体中否含有水蒸气;然后将气体通过甲,再检验气体还原氧化铜后的气体产物,氢气还原氧化铜生成水,可用丙来检验,为了排除干扰,先通过丙,检验是否有水蒸气生成,再通过乙检验是否有二氧化碳生成,从而判断气体中是否含有一氧化碳和氢气;故最佳的实验方案是将气体依次通入丙、甲、丙、乙.
故选:A.
点评 本题难度不大,熟练掌握常见气体的性质是正确解答此类题的关键,需要注意注意检验气体时要排除干扰因素,要检验是否含有水蒸气,通常放在第一步,检验二氧化碳要要放在水蒸气之后.

练习册系列答案
相关题目
9.下列材料中,不属于合成纤维的是( )
| A. | 尼龙 | B. | 腈纶 | C. | 棉花 | D. | 涤纶 |
7.下列图示的实验操作正确的是( )
| A. |  稀释浓硫酸 | B. |  测定溶液pH | ||
| C. |  过滤 | D. | . 验证中和反应 |
14.非诺洛芬是一种治疗类风湿关节炎的药物,化学式为C15H14O3,以下不正确的是( )
| A. | 该药物由三种元素组成 | B. | 一个非诺洛芬分子有32个原子 | ||
| C. | 该药物相对分子质量为242 | D. | 碳氢氧三种元素质量比为15:14:3 |
11.某白色固体A可能含有碳酸钠、氯化钡(水溶液呈中性)、氢氧化钠中的一种或几种,进行如下实验:
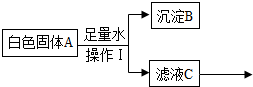
完成下列填空:
①根据上述实验分析,A中一定含有的物质是碳酸钠、氯化钡,写出生成B的化学方程式:Na2CO3+BaCl2═BaCO3↓+2NaCl.
②为进一步确定固体A中可能存在的物质,对滤液C进行实验,完成如表.

完成下列填空:
①根据上述实验分析,A中一定含有的物质是碳酸钠、氯化钡,写出生成B的化学方程式:Na2CO3+BaCl2═BaCO3↓+2NaCl.
②为进一步确定固体A中可能存在的物质,对滤液C进行实验,完成如表.
| 实验操作 | 现象 | 结论 |
| 向滤液C中加入足量的氯化钡溶液,充分反应后,静置,取上层清液滴加无色酚酞 | 无色酚酞变红色 | A中有氢氧化钠 |
8.下列各组离子可在同一溶液中大量共存的是( )
| A. | H+ SO42- K+ CO32- | B. | Mg2+ Cl- OH- Na+ | ||
| C. | Fe3+ SO42- H+ Cl- | D. | Na+ Ba2+ NO3- SO42- |