题目内容
8.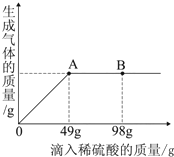 在一烧杯中盛有Na2CO3和Na2SO4组成的固体混合物,加入134克水使Na2CO3和Na2SO4全部溶解,向其中逐渐滴加溶质质量分数为20%的稀硫酸.生成气体的总质量与所滴入稀硫酸的质量关系曲线如图所示,请根据题意回答问题:
在一烧杯中盛有Na2CO3和Na2SO4组成的固体混合物,加入134克水使Na2CO3和Na2SO4全部溶解,向其中逐渐滴加溶质质量分数为20%的稀硫酸.生成气体的总质量与所滴入稀硫酸的质量关系曲线如图所示,请根据题意回答问题:(1)当滴加稀硫酸至A点时,放出的气体总质量为4.4g
(2)当滴加稀硫酸到B点时,溶液的pH值<7(填“>”“=”或“<”)
(3)当滴加稀硫酸到A点时,所得溶液为不饱和溶液,求所得溶液中溶质的质量分数.
分析 (1)根据碳酸钠与稀硫酸反应,由反应的硫酸的质量求出生成的二氧化碳、硫酸钠的以及参见反应的碳酸钠的质量;
(2)根据硫酸的溶液显酸性,溶液的pH小于7分析回答;
(3)根据溶质的质量分数的计算公式分析计算.
解答 解:(1)由图象可知,当加入稀硫酸的质量为49g时与碳酸钠恰好反应.
设Na2CO3的质量为x,生成的Na2SO4的质量为y,生成CO2的质量为z.
Na2CO3+H2SO4═Na2SO4+CO2↑+H2O
106 98 142 44
x 49g×20% y z
则$\frac{106}{x}=\frac{98}{49g×20%}=\frac{142}{y}=\frac{44}{z}$,解得:x=10.6g,y=14.2g,z=4.4g.
(2)由图线可知,当滴加稀硫酸到B点时,溶液中有过量的稀硫酸,溶液显酸性,溶液的pH是7;
(3)当滴加稀硫酸至图中A点时,溶液中硫酸钠的质量是:14.2g+(22.g-10.6)g=14.2g+11.8g=26g
总溶液=22.4g+84g+49g-4.4g=151g.
所得溶液中溶质的质量分数为Na2SO4%=$\frac{26g}{151g}$×100%=17.2%
故答案为:(1)4.4g;(2)<;(3)17.2%.
点评 本题难度较大,主要考查了根据化学方程式进行计算和有关溶液中溶质质量分数的计算,从而培养学生对概念的应用和分析问题、解决问题的能力.

练习册系列答案
相关题目
18. 如图“五连环”中的每一环表示一种物质,在一定条件下,相连环物质间能发生反应,不相连环物质间不能发生反应.已知A、B、C、D分别是铁、氧气、二氧化碳、氯化钡溶液、氢氧化钠溶液中的一种物质.若A为氧气,则D的化学式为( )
如图“五连环”中的每一环表示一种物质,在一定条件下,相连环物质间能发生反应,不相连环物质间不能发生反应.已知A、B、C、D分别是铁、氧气、二氧化碳、氯化钡溶液、氢氧化钠溶液中的一种物质.若A为氧气,则D的化学式为( )
 如图“五连环”中的每一环表示一种物质,在一定条件下,相连环物质间能发生反应,不相连环物质间不能发生反应.已知A、B、C、D分别是铁、氧气、二氧化碳、氯化钡溶液、氢氧化钠溶液中的一种物质.若A为氧气,则D的化学式为( )
如图“五连环”中的每一环表示一种物质,在一定条件下,相连环物质间能发生反应,不相连环物质间不能发生反应.已知A、B、C、D分别是铁、氧气、二氧化碳、氯化钡溶液、氢氧化钠溶液中的一种物质.若A为氧气,则D的化学式为( )| A. | Fe | B. | CO2 | C. | BaCl2 | D. | NaOH |
19.(1)人们常说:①高原上缺氧 ②生理盐水 ③胃酸过多 ④发酵粉中的小苏打.请用H、C、O、Na、Cl四种常见的元素,写出其中的化学式:①中的“氧”O2;②中的“盐”NaCl③中的“酸”HCl;④中的小苏打NaHCO3
(2)无土栽培是利用营养液栽培作物的一种方法.以下是栽培绿叶菜营养液配方.
①化学肥料成份中属于复合肥的肥料名称是磷酸二氢钾.
②该营养液中存在的一种金属离子符号Ca2+.
③硫酸镁中硫元素的化合价+6.
④若在实验里配制20升该营养液,需要称取的硫酸钾的质量是5000毫克.
(2)无土栽培是利用营养液栽培作物的一种方法.以下是栽培绿叶菜营养液配方.
| 肥料成份名称 | 用量(毫克∕升) |
| 硝酸钙 | 1260 |
| 硫酸钾 | 250 |
| 磷酸二氢钾 | 350 |
| 硫酸镁 | 537 |
| 硫酸铵 | 237 |
②该营养液中存在的一种金属离子符号Ca2+.
③硫酸镁中硫元素的化合价+6.
④若在实验里配制20升该营养液,需要称取的硫酸钾的质量是5000毫克.
3.茶叶中含有的茶氨酸(C7H14O3N2)可以降低血压、提高记忆力、保护神经细胞等.下列有关茶氨酸的说法中,正确的是( )
| A. | 茶氨酸属于有机高分子化合物 | |
| B. | 茶氨酸中碳元素与氢元素的质量比为1:2 | |
| C. | 茶氨酸中碳元素的质量分数最大 | |
| D. | 一个茶氨酸分子中含有一个氮分子 |
20.下面是家庭中常见物质的pH,其中显酸性最强是( )
| A. | 酱油(pH=5) | B. | 厕所清洁剂(pH=1) | C. | 柠檬(pH=3) | D. | 橘子(pH=4) |
 某溶液含有Cu(NO3)2和AgNO3,现向其中加入一定量的锌粉,参加反应的锌的质量与溶液中金属离子种类的关系如图所示.请回答下列问题.
某溶液含有Cu(NO3)2和AgNO3,现向其中加入一定量的锌粉,参加反应的锌的质量与溶液中金属离子种类的关系如图所示.请回答下列问题.
 如图分别表示A、B两种物质的溶解度曲线,试回答:
如图分别表示A、B两种物质的溶解度曲线,试回答: