题目内容
18.小齐同学做了如图所示的实验.
若实验中所加物质每步均恰好完全反应(滤液损失忽略不计),请回答下列问题:
(1)写出实验中发生反应的化学方程式Fe2O3 +6HCl=2FeCl3+3H2O;3NaOH+FeCl3═Fe(OH)3↓+3NaCl;
(2)该赤铁矿石中氧化铁的纯度为80%;
(3)根据已知条件列出求解实验生成沉淀物质的质量(x)的比例式$\frac{120}{24g}=\frac{107}{x}$;
(4)在滴加氢氧化钠溶液的过程中,烧杯中溶质质量的变化情况为质量增加;
(5)若将反应后的滤液蒸发掉43.6g水,则所得不饱和溶液中溶质的质量分数为10%.
(6)若用溶质质量分数为36.5%的浓盐酸配制实验中所需的稀盐酸,则需要浓盐酸和水的质量最简比为3:7.
(7)560t这样的铁矿石和1325.7t含杂质30%菱铁矿石炼出的铁质量相同.
分析 (1)根据氧化铁与盐酸反应生成氯化铁和水解答;氯化铁和氢氧化钠反应生成氢氧化铁沉淀和氯化钠解答;
(2)根据氢氧化钠的质量求出氯化铁的质量,从而求出氧化铁的质量;
(3)根据氯化铁和氢氧化钠反应生成氢氧化铁沉淀和氯化钠解答;
(4)根据反应原理分析解答;
(5)根据第二次反应的氧化铁的质量,计算出生成的氯化铁的质量,根据溶质的质量分数计算公式即可解得;
(6)根据溶质质量一定,利用溶质质量分数公式进行计算即可.
(7)根据铁元素质量相等列出等量关系,
解答 解:
(1)赤铁矿的主要成分是氧化铁,氧化铁与盐酸反应生成氯化铁和水,反应的化学方程式为:Fe2O3 +6HCl=2FeCl3+3H2O;
氯化铁和氰化钠反应生成氢氧化铁沉淀和氯化钠,反应的化学方程式为:3NaOH+FeCl3═Fe(OH)3↓+3NaCl.
(2)设该赤铁矿石中氧化铁的质量为x
由Fe2O3 +6HCl=2FeCl3+3H2O;3NaOH+FeCl3═Fe(OH)3↓+3NaCl.可知:
Fe2O3 ~6NaOH
160 240
x 200g×12%
$\frac{160}{x}=\frac{240}{200g×12%}$
x=16g
该赤铁矿石中氧化铁的纯度为$\frac{16g}{20g}×$100%=80%;
(3)设实验生成沉淀物质的质量为x,生成氯化钠的质量为y
氢氧化钠的质量为200g×12%=24g
3NaOH+FeCl3═Fe(OH)3↓+3NaCl
120 107 175.5
24g x y
$\frac{120}{24g}=\frac{107}{x}$
x=21.4g
$\frac{120}{24g}=\frac{175.5}{y}$
y=35.1g
(4)由3NaOH+FeCl3═Fe(OH)3↓+3NaCl
120 107
可知:每加入120份质量的氢氧化钠,生成沉淀107份,溶液增加13份;故在滴加氢氧化钠溶液的过程中,烧杯中溶质质量的变化情况为质量增加;
(5)若将反应后的滤液蒸发掉43.6g水,则所得不饱和溶液中溶质的质量分数为$\frac{35.1g}{16g+200g+200g-21.4g-43.6g}×$100%=10%;
(6)由Fe2O3 +6HCl=2FeCl3+3H2O;3NaOH+FeCl3═Fe(OH)3↓+3NaCl.
可知:HCl~NaOH 设HC的质量为z
36.5 40
z 24g
$\frac{36.5}{z}=\frac{40}{24g}$
z=21.9g
用溶质质量分数为36.5%的浓盐酸为:$\frac{21.9g}{36.5%}$=60g
加入水的质量为:200g-60g=140g
需要浓盐酸和水的质量最简比为60g:140g=3:7;
(7)560t这样的铁矿石中铁的质量=560t×80%=448t
菱铁矿石的质量=448t$÷\frac{56}{116}×$100%÷(1-30%)≈1325.7t
答案:
(1)Fe2O3 +6HCl=2FeCl3+3H2O;3NaOH+FeCl3═Fe(OH)3↓+3NaCl.
(2)80%;
(3)$\frac{120}{24g}=\frac{107}{x}$;
(4)质量增加;
(5)10%;
(6)3:7;
(7)1325.7t
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,同时考查了分析数据的能力,计算时要注意规范性和准确性.

| A. | 生铁和钢的性能完全相同 | B. | 炼铁过程只发生物理变化 | ||
| C. | 常温下所有金属均为固态 | D. | 铁在潮湿的空气中易生锈 |
| A. | 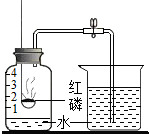 烧杯中的水进入集气瓶至刻度1处,说明氮气不易溶于水 烧杯中的水进入集气瓶至刻度1处,说明氮气不易溶于水 | |
| B. |  干燥的用石蕊染成紫色的纸花不变色,说明二氧化碳不显酸性 干燥的用石蕊染成紫色的纸花不变色,说明二氧化碳不显酸性 | |
| C. |  黄铜片与铜片相互刻画,铜片上有划痕,说明合金的硬度比纯金属大 黄铜片与铜片相互刻画,铜片上有划痕,说明合金的硬度比纯金属大 | |
| D. |  反应后称得物质的质量减小,说明该反应不遵守质量守恒定律 反应后称得物质的质量减小,说明该反应不遵守质量守恒定律 |
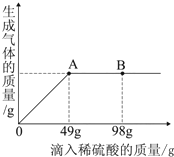 在一烧杯中盛有Na2CO3和Na2SO4组成的固体混合物,加入134克水使Na2CO3和Na2SO4全部溶解,向其中逐渐滴加溶质质量分数为20%的稀硫酸.生成气体的总质量与所滴入稀硫酸的质量关系曲线如图所示,请根据题意回答问题:
在一烧杯中盛有Na2CO3和Na2SO4组成的固体混合物,加入134克水使Na2CO3和Na2SO4全部溶解,向其中逐渐滴加溶质质量分数为20%的稀硫酸.生成气体的总质量与所滴入稀硫酸的质量关系曲线如图所示,请根据题意回答问题: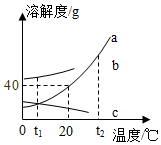 溶液在生产和生活中有着重要意义.如图a、b、c三种固体物质的溶解度曲线请回答下列相关问题:
溶液在生产和生活中有着重要意义.如图a、b、c三种固体物质的溶解度曲线请回答下列相关问题: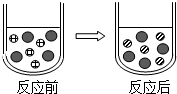 组成相似的盐具有一些相似的化学性质.
组成相似的盐具有一些相似的化学性质. Fe2+、
Fe2+、 S${{O}_{4}}^{2-}$、
S${{O}_{4}}^{2-}$、 Mg2+.
Mg2+.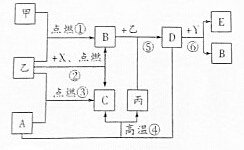 如图所示是初中化学中常见物质间的转化关系(部分生成物已略去),其中甲、乙为气态单质,丙是目前应用最广泛的金属,A、B、C、D均为氧化物,常温下B为液态,化合物E的水溶液呈黄色.
如图所示是初中化学中常见物质间的转化关系(部分生成物已略去),其中甲、乙为气态单质,丙是目前应用最广泛的金属,A、B、C、D均为氧化物,常温下B为液态,化合物E的水溶液呈黄色.