题目内容
20.下面是家庭中常见物质的pH,其中显酸性最强是( )| A. | 酱油(pH=5) | B. | 厕所清洁剂(pH=1) | C. | 柠檬(pH=3) | D. | 橘子(pH=4) |
分析 当溶液的pH等于7时,呈中性.当溶液的pH大于7时,呈碱性.当溶液的pH小于7时,呈酸性.当溶液的pH小于7时,随着pH的减小酸性增强.
解答 解:当溶液的pH小于7时,呈酸性.当溶液的pH小于7时,随着pH的减小酸性增强,
A、酱油pH=5,显酸性;
B、厕所清洁剂,pH=1,显酸性,pH值最小,所以酸性最强.
C、柠檬汁pH=3,显酸性;
D、但是橘子pH=4,显酸性;
故选B.
点评 解答本题要掌握溶液的酸碱性和溶液pH大小之间的关系,然后再根据具体物质的水溶液的酸碱性进行分析、判断,从而得出正确的结论.

练习册系列答案
相关题目
10.实验是学习化学的一条重要途径.下列化学实验操作正确的是( )
| A. |  检查装置气密性 | B. |  测溶液pH | C. |  塞紧橡皮塞 | D. |  加热固体物质 |
11.老师从实验桌上拿出两瓶常用但标签已经模糊不清的试剂.分别是固体和液体,他分别取少量试剂在试管中混合,立即产生一种无色气体.小花同学对此展开了一系列探究:
(1)此气体是什么物质?验证它的实验方案如下:
(2)小花想制取该气体,她选择A为发生装置,选择的理由是反应物是固体和液体,且反应不需加热

(3)小花猜想无色气体还可能是另一种气体,反应的化学方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,收集装置可选取D(或E)(填字母),理由是氧气密度比空气大(或氧气不易溶于水).
(4)实验室用氯化铵固体和氢氧化钙粉末混合加热来制取氨气,同时还生成氯化钙和水.写出制取氨气的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑,选取上述BC(填字母)作为制取氨气的装置.
(1)此气体是什么物质?验证它的实验方案如下:
| 猜想 | 实验步骤 | 现象及结论 |
| 小花认为此气体可能是二氧化碳 | 将气体通入 澄清的石灰水 | 澄清的石灰水变浑浊 此气体是二氧化碳 |

(3)小花猜想无色气体还可能是另一种气体,反应的化学方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,收集装置可选取D(或E)(填字母),理由是氧气密度比空气大(或氧气不易溶于水).
(4)实验室用氯化铵固体和氢氧化钙粉末混合加热来制取氨气,同时还生成氯化钙和水.写出制取氨气的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑,选取上述BC(填字母)作为制取氨气的装置.
15.下列物质中,属于混合物的是( )
| A. | 矿泉水 | B. | 冰水共存物 | C. | 水蒸气 | D. | 水银 |
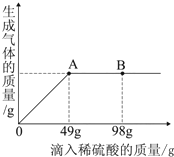 在一烧杯中盛有Na2CO3和Na2SO4组成的固体混合物,加入134克水使Na2CO3和Na2SO4全部溶解,向其中逐渐滴加溶质质量分数为20%的稀硫酸.生成气体的总质量与所滴入稀硫酸的质量关系曲线如图所示,请根据题意回答问题:
在一烧杯中盛有Na2CO3和Na2SO4组成的固体混合物,加入134克水使Na2CO3和Na2SO4全部溶解,向其中逐渐滴加溶质质量分数为20%的稀硫酸.生成气体的总质量与所滴入稀硫酸的质量关系曲线如图所示,请根据题意回答问题: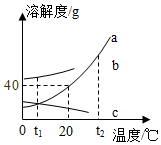 溶液在生产和生活中有着重要意义.如图a、b、c三种固体物质的溶解度曲线请回答下列相关问题:
溶液在生产和生活中有着重要意义.如图a、b、c三种固体物质的溶解度曲线请回答下列相关问题: