题目内容
20.某同学配制50g溶质质量分数为5%的KCl溶液,准备了下列实验用品.回答下列问题:
(1)该同学按下列实验步骤进行:①计算,②称量,③量取,④溶解(填步骤名称)⑤装瓶.
(2)实验过程中除缺少细口瓶还缺少的一种玻璃仪器是玻璃棒(填名称).该仪器的作用是搅拌,加速溶解.
(3)为了达到本实验目的,应用量筒量取47.5mL的水倒入烧杯中.在量取水的体积时,小刚同学俯视读数,则所配制溶液中氯化钾的质量分数偏大(填“偏大”、“偏小”或“不变”)
(4)已知氯化钾20℃时的溶解度是34g,50℃时溶解度是42,6g,通过如图所示的实验操作得到相应的溶液,在所得溶液中,属于不饱和溶液的是AC(填字母,下同),溶质的质量分数相同的是BE.

分析 (1)根据配制溶液的步骤解答;
(2)根据配置溶液所需仪器解答;
(3)根据溶质质量=溶液质量×溶质质量分数解答;根据量筒的使用方法进行解答.
(4)根据固体的溶解度是指在一定温度下,某固体物质在100g水中达到饱和状态时所溶解的质量,根据固体物质的溶解度可以判断出在一定温度时形成的溶液是否饱和进行解答.
解答 解:
(1)配制溶液的步骤是:①计算,②称量,③量取,④溶解,⑤装瓶;
(2)配制过程除了用到图中所需仪器,还缺少玻璃棒;该仪器的作用是搅拌,加速溶解.
(3)配制50g溶质质量分数为5%的KCl溶液,需KCl的质量为0g×5%=2.5g;水的质量=50g-2.5g=47.5g,合47.5mL;俯视读数会导致量取的液体的体积偏小,从而导致所配制的溶液的溶质的质量分数偏大;
(4)由于氯化钾在20℃时的溶解度是34g,即100g水中最多溶解34g氯化钾,因此在20℃时在100g水中加入20g氯化钾,氯化钾会全部溶解,得到的A溶液是20℃不饱和溶液;又加入20g氯化钾,由于在100g水中最多溶解34g氯化钾,因此这20g氯化钾只能再溶解14g,所以形成的B溶液是20℃饱和溶液;升温至50℃,由于氯化钾在50℃时的溶解度是42.6g,因此后加入的氯化钾会全部溶解,而且形成的溶液C是50℃不饱和溶液,但又加入20g氯化钾,这20g氯化钾会再溶解2.6g,形成的溶液D是50℃饱和溶液,然后降温到20℃时,有晶体析出,形成溶液E是20℃饱和溶液.
故属于不饱和溶液的是AC,溶质的质量分数相同的是BE.
故答案为:
(1)溶解;(2)玻璃棒;搅拌,加速溶解; (3)47.5;偏大;(4)AC; BE.
点评 本题难度不大,主要考查了对固体溶解度概念的理解,从而培养学生对知识的应用能力和理解能力.熟练掌握配制溶液的步骤,仪器,溶质的质量分数计算是解答此题的基础和关键.

A只有氢氧化钠固体
B只有碳酸钠固体
C你认为还可能是NaOH和Na2CO3的混合物固体
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质.该固体变质的化学方程式2NaOH+CO2═Na2CO3+H2O;则无色溶液可能是稀盐酸或稀硫酸、稀硝酸.
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验.已知碳酸钠的水溶液呈碱性,它的存在会对氢氧化钠的检验造成干扰.请根据下表部分物质的溶解性表(20℃)所提供的信息,将如表填写完整.
| 阴离子 阳离子 | OH- | NO3- | Cl- | SO42- | CO32- |
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 溶 | 不溶 | 不溶 |
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
| 除去碳酸钠 | 取少量该固体样品溶于水配成溶液,滴加适量的BaCl2溶液.充分反应后过滤 | 有白色沉淀生成 | 有关反应的化学方程式为 Na2CO3+BaCl2═BaCO3↓+2NaCl |
| 检验是否含有氢氧化钠 | 在滤液中滴加酚酞溶液 | 变红 | 该样品中含有氢氧化钠 |
| A. | 在山林中遇火灾时,尽量向逆风方向奔跑,脱离火灾区 | |
| B. | 室内起火,立即打开所有门窗 | |
| C. | 有烟雾的地方,尽量贴近地面逃离 | |
| D. | 烟雾很大时,用湿毛巾捂住口鼻 |
| A. | 增加私家车用量,提高生活质量 | |
| B. | 大力发展风能,减少火力发电 | |
| C. | 农作物秸秆多翻土还田,不露天焚烧 | |
| D. | 居民多用天然气,少用煤作燃料 |
| A. | 铜片 | B. | 浓盐酸 | C. | 石灰石 | D. | 氯化钠 |
①CO2+Na2CO3+H2O═2NaHCO3,CO2通入饱和碳酸钠溶液会产生白色沉淀,CO2不溶于饱和碳酸氢钠溶液.
②碳酸钠、碳酸氢钠在不同温度下的溶解度
| 0℃ | 10℃ | 20℃ | 30℃ | |
| Na2CO3 | 7.1 | 12.2 | 21.8 | 39.7 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 |
①配制碳酸钠溶液:取100g 20℃的水,加入35g碳酸钠固体,搅拌后,静置,取上层清液.
②利用装置一进行实验,连续5分钟向新制得的碳酸钠溶液中通入CO2.

【发现问题】实验中,始终没有看到沉淀现象,原因是什么呢?雯雯进行了以下实验探究.
【进行实验2】
| 实验操作 | 实验现象 |
| ①取100g 20℃的水,加入35g碳酸钠固体,搅拌后,静置,取上层清液 ②利用装置二进行实验,连续5分钟向新制得的碳酸钠溶液中通入CO2 | 没有出现白色沉淀 |
(2)大理石与稀盐酸反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.
(3)装置二中饱和碳酸氢钠溶液的作用是吸收氯化氢气体,从而排除氯化氢气体对实验的干扰.
【进行实验3】
| 实验操作 | 实验现象 |
| ①取100g热开水,加入35g碳酸钠固体,完全溶解,再降温至20℃,取上层清液 ②利用装置一和装置二分别进行实验,连续3分钟向新制得的碳酸钠溶液中通入CO2 | 装置一和装置二中的碳酸钠溶液中均出现白色沉淀 |
(5)CO2通入饱和碳酸钠溶液会产生白色沉淀的原因是碳酸氢钠溶解度小于碳酸钠,随着反应的进行,水的质量减小,生成的碳酸氢钠的质量大于反应的碳酸钠.
(6)请你依据题中信息,写出一种能够区分碳酸钠和碳酸氢钠固体的实验方案方法一:取其中一种固体12g,加入100g热开水,充分溶解后,降温至20℃.若有固体析出,为碳酸氢钠,否则为碳酸钠;
方法二:取其中一种固体12g,加入100g20℃的水,充分溶解后,若有白色固体剩余,为碳酸氢钠,否则为碳酸钠.

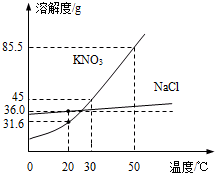 如图为NaCl、KNO3的溶解度曲线(水的密度约为1g/cm3).
如图为NaCl、KNO3的溶解度曲线(水的密度约为1g/cm3).