题目内容
4.现有铜与另一种金属的混合物粉末,另一种金属可能是镁、铁、锌中的一种,现欲测定其组成.取该混合物粉末8.0g放入烧杯中,将140.0g 14.0%的稀硫酸分四次加入该烧杯中,充分反应后,测得剩余固体质量数据记录如下:| 次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的质量/g | 35.0 | 35.0 | 35.0 | 35.0 |
| 剩余固体的质量/g | 6.8 | 5.6 | 4.4 | 4.2 |
(1)该混合物粉末中铜的质量分数为52.5%;
(2)该混合物粉末中另一金属为镁;
(3)发生反应的化学方程式Mg+H2SO4=MgSO4+H2↑;
(4)列出求总共消耗稀硫酸溶质质量(x)的比例式:$\frac{24}{2.4g}=\frac{2}{x}$;
(5)如果第三次加入硫酸充分反应后的溶液蒸发掉8.3g水,且无结晶析出,则所得溶液中溶质的质量分数为18%.
分析 根据表中数据可以判断出1、2、3次反应中,稀硫酸完全反应,4次反应中稀硫酸过量;
根据反应的硫酸质量和固体质量可以计算金属的相对原子质量,从而可以判断金属是什么;
溶质质量分数=$\frac{溶质质量}{溶液质量}$×100%;
溶液稀释前后,溶质质量不变.
解答 解:(1)该混合物中铜的质量分数为:$\frac{4.2g}{8g}$×100%=52.5%,
故填:52.5%.
(2)设金属元素符号是M,相对原子质量是y,
以第一次实验数据进行计算,
M+H2SO4═MSO4+H2↑,
y 98
1.2g 35.0g×14.0%
$\frac{y}{1.2g}=\frac{98}{35.0g×14.0%}$,
y=24,
金属是镁,故填:镁;
(3)镁和稀硫酸反应的化学方程式为:Mg+H2SO4=MgSO4+H2↑.
故填:Mg+H2SO4=MgSO4+H2↑.
(3)设生成的氢气质量为x,
Mg+H2SO4=MgSO4+H2↑,
24 2
2.4g x
$\frac{24}{2.4g}=\frac{2}{x}$,
故填:$\frac{24}{2.4g}=\frac{2}{x}$.
(4)设生成硫酸锌的质量为z,生成氢气的质量为n,
Mg+H2SO4=MgSO4+H2↑,
24 120 2
3.6g z n
$\frac{24}{3.6g}=\frac{120}{z}$,$\frac{24}{3.6g}=\frac{2}{n}$
z=18g,n=0.3g,
所得溶液质量为:35.0g×3+3.6g-0.3g-8.3g=100g,
所得不饱和溶液中溶质的质量分数为:$\frac{18g}{100g}$×100%=18%,
故填:18%.
点评 溶液浓缩或稀释时,只是改变溶液的溶质质量分数,而溶液中溶质质量不变,要注意理解.

 备战中考寒假系列答案
备战中考寒假系列答案| 实验 | 1 | 2 | 3 | 4 |
| 加入样品是质量/g | 6.5 | 13 | 19.5 | 26 |
| 生成H2的质量/g | 0.16 | 0.32 | 0.40 | m |
?(2)试计算这种锌粒样品中锌的质量分数(写出计算过程).
| A. | 相同温度下饱和溶液一定比不饱和溶液浓 | |
| B. | 饱和溶液一定是浓溶液 | |
| C. | 不饱和溶液降温一定会变成饱和溶液 | |
| D. | 对于同一溶质的溶液同一温度时饱和溶液一定比不饱和溶液浓 |
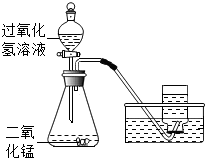 某同学在实验室用溶质质量分数为10%过氧化氢溶液和二氧化锰制取氧气,恰好完全反应,实验的相关数据如下表.
某同学在实验室用溶质质量分数为10%过氧化氢溶液和二氧化锰制取氧气,恰好完全反应,实验的相关数据如下表.| 发生装置内物质的总质量 | |
| 反应前 | 34.3g |
| 反应后 | 32.7g |
(2)计算原混合物中二氧化锰的质量,并写出必要的计算过程.