题目内容
15.综合实践课时同学们对滨海某家印刷工厂排出的污水展开探究,以下是同学们的做法,请你参与其中,回答有关问题:Ⅰ、首先用pH试纸(或pH计)检测污水的酸碱度,测得pH>7.
Ⅱ、利用中和反应原理测定污水中污染物(设为烧碱)的质量分数.甲、乙两同学设计的方案分别如图1、图2所示:

(1)甲同学实验时向烧杯你滴加稀盐酸直至溶液颜色恰好变为无色为止,酚酞溶液的作用是指示是否恰好完全反应,防止盐酸过量;边滴加稀盐酸,边要用玻璃棒不断搅拌的目的是使反应充分进行;甲同学在滴加稀盐酸一段时间后.发現溶液中有少量气泡产生这“异常現象”,请用化学方程式表示产生这一“异常现条“的原因CO2+2NaOH=Na2CO3+H2O 2HCl+Na2CO3=2NaCl+CO2↑+H2O.
(2)乙同学按图2反应后,取少量反应后溶液于试管中滴加酚酞试液,酚酞不变色,得出结论:两种物质恰好中和.你认为他的结论不正确(选填“正确“或“不正确“),理由是盐酸过量无色酚酞不变色,若乙同学欲证明白己的猜想正确,下列试剂可以选用的是ABD
A、紫色石蕊 B、镁条 C.AgNO3溶液 D.碳酸钠
(3)丙同学在乙同学的方案基础上,利用了连线在传感器上的计算机,随机绘制出了溶液的pH随加入稀盐酸质量变化的曲线,结果如图3所示,计算该污水中烧碱的浓度是4%.若丙同学改用同浓度的稀硫酸代替盐酸来进行此反应,当滴加稀硫酸至18g时溶液中所含有的阴离子是SO42-.
分析 Ⅰ.通常用pH来表示溶液的酸碱性强弱程度.
Ⅱ.
(1)根据酚酞试液在碱性溶液为红色分析结论的正确性;根据硫酸和氢氧化钠反应生成硫酸钠和水;紫色石蕊试液在酸性、碱性、中性溶液中的颜色分析反应的程度并通过化学方程式进行计算;根据实验的注意事项分析玻璃棒的作用;根据氢氧化钠与二氧化碳的反应写出氢氧化钠变质的方程式.
(2)根据酚酞试液在碱性溶液为红色分析结论的正确性;
(3)根据氢氧化钠与盐酸的反应,由盐酸溶质的质量求出氢氧化钠的质量,再求出氢氧化钠溶液中溶质的质量分数;
解答 解:
Ⅰ.通常用pH来表示溶液的酸碱性强弱程度;
Ⅱ.
(1)滴加稀盐酸直至溶液颜色恰好变为无色为止,酚酞溶液的作用是指示是否恰好完全反应,防止盐酸过量;边滴加稀盐酸,边要用玻璃棒不断搅拌的目的是使反应充分进行;氢氧化钠变质的原因是氢氧化钠与空气中的二氧化碳反应,反应的方程式是:CO2+2NaOH=Na2CO3+H2O.碳酸钠和盐酸反应,反应的方程式是:2HCl+Na2CO3=2NaCl+CO2↑+H2O;
(2)根据取少量反应后的溶液于试管中,滴加几滴无色酚酞试液,酚酞不变色,因为盐酸过量无色酚酞也不变色;若乙同学欲证明白己的猜想正确,可以加紫色石蕊,如果不变色,证明恰好完全反应;加镁条 没有气泡,证明恰好完全反应;加碳酸钠没有气泡,证明恰好完全反应;加硝酸银,因为氯化钠和硝酸银反应,也能产生沉淀,故不能选;
(3)pH=7,说明恰好完全反应;
设该污水中烧碱的质量为x,稀盐酸中HCl的质量=14.6g×5%=0.73g
HCl+NaOH═NaCl+H2O
36.5 40
0.73g x
$\frac{36.5}{0.73g}=\frac{40}{x}$
x=0.8g
所以污水中氢氧化钠的质量分数为$\frac{0.8g}{20g}×$100%=4%
滴加稀硫酸至18g时,pH小于7,溶液呈酸性,溶液中所含有的阴离子SO42-
答案:
Ⅰ. pH试纸(或pH计)
Ⅱ.(1)指示是否恰好完全反应,防止盐酸过量 使反应充分进行
CO2+2NaOH=Na2CO3+H2O 2HCl+Na2CO3=2NaCl+CO2↑+H2O
(2)不正确 盐酸过量无色酚酞不变色 ABD
(3)4% SO42-
点评 本题考查了酸碱度的测定方法的评价,酸碱性与pH的关系以及酸碱中和反应的运用等,综合性较强,但难度不大,关键还是熟练掌握溶液酸碱性、酸碱度测定的方法及酸碱中和反应的原理.


| A. | 液体丙呈红色或无色 | |
| B. | 该样品中一定含有碳酸钙 | |
| C. | 若液体丙呈无色,说明该样品已部分变质 | |
| D. | 白色固体甲可能为Ca(OH)2和CaCO3的混合物 |
 化学反应也有“悄悄”进行的.小明和他的同学对二氧化碳与氢氧化钠溶液的反应进行了如下探究.
化学反应也有“悄悄”进行的.小明和他的同学对二氧化碳与氢氧化钠溶液的反应进行了如下探究.探究一:二氧化碳是否与氢氧化钠发生了化学反应?
将二氧化碳通入盛有氢氧化钠溶液的大试管(如图).取少量大试管中的液体于另一支试管中,滴加足量的稀盐酸,观察到有气泡产生,证明二氧化碳与氢氧化钠发生了反应;
探究二:反应后大试管中的溶液所含溶质的成分是什么?
【提出猜想】小明认为溶质是Na2CO3;小刚认为溶质是Na2CO3和NaOH
【查阅资料】CaCl2溶液呈中性
【实验验证】
小刚为了验证自己的猜想,进行了如下实验,请你补充完整.
| 实验操作 | 实验现象 | 实验结论 |
| ①取一定量试管中的溶液于试管中,加入足量CaCl2溶液,过滤;②向滤液滴加适量酚酞试液. | 酚酞试液变红 | 小刚猜想成立 |
【实验拓展】同学们联想到氢氧化钠与稀硫酸发生中和反应也观察不到明显现象,为了确定其反应是否发生,由同学设计了如下的实验方案:先用pH试纸测定氢氧化钠溶液的pH,然后向其中滴加稀硫酸,边滴加边测定混合溶液的pH.请你分析上述方案中,为什么要“当测定pH小于或等于7时”才可证明发生反应了,其原因是pH小于或等于7时,表明OH-被消耗,说明酸碱发生了反应.
【总结提高】试设计两种不同方案证明氢氧化钠和稀硫酸确实发生了反应,从实验操作、实验现象和实验结论等方面加以说明.
| 实验操作 | 实验现象 | 实验结论 | |
| 方案一 | 在氢氧化钠溶液中滴加1~2滴酚酞试液,再向其中滴加稀硫酸 | 酚酞试液由红色变为无色 | 氢氧化钠和稀硫酸发生了反应. |
| 方案二 | 在常温的氢氧化钠溶液中滴加同温稀硫酸用温度计测量混合液的温度 | 混合液温度明显升高 |

(1)气体A溶液的pH>7.
(2)沉淀D的化学式为BaSO4.
(3)一定有的物质是CuO、Na2SO4.
(4)该固体混合物中,还不能确定存在的是NH4Cl或NH4NO3,(写化学式)要进一步推理该固体混合物的组成,可用溶液E再实验确定可能含有的物质:
| 实验操作 | 实验现象 | 实验结论 |
| 取未知成分溶液E少许,加入硝酸银溶液, | 出现白色沉淀 | NH4Cl(用化学式表示) |

Ⅰ.探究碱的化学性质
①实验甲,随着稀盐酸的不断滴入,观察到溶液由红色变为无色;
②实验乙滴加氢氧化钠溶液后,观察到的气球变鼓;
③实验丙观察到试管内有白色沉淀产生,发生反应的化学方程式为Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
Ⅱ.探究废液成分
实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,由此产生疑问.
【提出问题】废液中含有哪些物质?
【查阅资料】BaCl2溶液呈中性且Na2CO3+BaCl2═BaCO3↓+2NaCl
【讨论交流】
①废液中一定含有的物质:碳酸钙、指示剂、水和氯化钠;
②还含有能使废液呈碱性的物质,同学们有如下猜想:
猜想1:碳酸钠;猜想2:氢氧化钠;
猜想3:氢氧化钠和碳酸钠;猜想4:氢氧化钠和氢氧化钙.
【查阅资料】BaCl2溶液呈中性,Na2CO3+BaCl2=BaCO3↓+2NaCl
【实验设计】
同学们认为需要先验证猜想4是否成立,所需要的试剂是碳酸钠溶液.
若猜想4不成立,则需要进行后续实验,请你完成表格.
| 实验操作 | 预计现象 | 预计结论 |
| 取少量废液缸中上层清液于试管中,加入过量氯化钡溶液,静置 | 有白色沉淀,溶液无色 | 猜想1正确 |
| 若没有白色沉淀,溶液呈红色 | 猜想2正确 | |
| 有白色沉淀,溶液呈红色 | 猜想3正确 |
【反思拓展】分析化学反应后所得物质成分时,除考虑生成物外还需考虑反应物是否有剩余.
 ”表示氧原子,“
”表示氧原子,“ ”表示氢原子.请回答下列问题.
”表示氢原子.请回答下列问题.
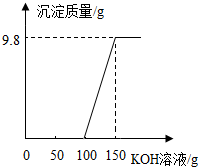 电镀厂的废水中含有H2SO4和CuSO4,为了回收CuSO4并得到化肥,工厂化验室取来200g废水,逐滴加入KOH溶液,反应情况如图所示,请回答:
电镀厂的废水中含有H2SO4和CuSO4,为了回收CuSO4并得到化肥,工厂化验室取来200g废水,逐滴加入KOH溶液,反应情况如图所示,请回答: 人类的生产生活都离不开水,水是最常见的液体.
人类的生产生活都离不开水,水是最常见的液体.