题目内容
16.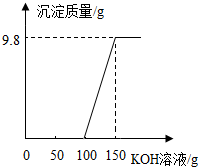 电镀厂的废水中含有H2SO4和CuSO4,为了回收CuSO4并得到化肥,工厂化验室取来200g废水,逐滴加入KOH溶液,反应情况如图所示,请回答:
电镀厂的废水中含有H2SO4和CuSO4,为了回收CuSO4并得到化肥,工厂化验室取来200g废水,逐滴加入KOH溶液,反应情况如图所示,请回答:(1)K2SO4属于钾肥;
(2)求所用的KOH溶液的溶质质量分数.(写解题过程)
(3)如每天处理200吨废水,可制得52.2吨K2SO4.
分析 根据“生成Cu(OH)2沉淀质量与所加KOH溶液质量关系”图,分析反应进行的情况,然后分别根据反应的化学方程式进行计算.
解答 解:(1)K2SO4属于含有钾元素,属于钾肥.
(2)由关系图可知,有150g-100g=50g,KOH溶液与废水中的硫酸铜发生反应;
设50gKOH溶液中KOH的质量为y,
CuSO4+2KOH=K2SO4+Cu(OH)2↓
112 98
y 9.8g
$\frac{112}{y}$=$\frac{98}{9.8g}$
解之得 y=11.2g
所用的KOH溶液的溶质质量分数$\frac{11.2g}{50g}$×100%=22.4%;
(3)如每天处理200吨废水,需要KOH溶液150吨,设可得硫酸钾的质量为x,
由CuSO4+2KOH=K2SO4+Cu(OH)2↓和2NaOH+H2SO4=Na2SO4+2H2O可得KOH与K2SO4的关系为
:2KOH~K2SO4
112 174
150t×22.4% x
$\frac{112}{150t×22.4%}$=$\frac{174}{x}$
x=52.2t
故答案为:(1)钾肥.
(2)22.4%;
(3)52.2t.
点评 正确地分析图象是解题的关键.分析沉淀的质量与所滴入KOH溶液的质量关系曲线时,曲线起点表明混合溶液中硫酸恰好完全反应,曲线折点表明硫酸铜恰好与氢氧化钾完全反应.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
6.空气是人类宝贵的自然资源.下列有关空气的说法错误的是( )
| A. | 液氮可用于医疗手术 | B. | 水蒸气易导致固体烧碱潮解 | ||
| C. | 铁在潮湿的空气中不易生锈 | D. | 二氧化碳是光合作用必需的物质 |
7.根据表屮的数据,回答下列问题.
(1)分析上表可知,在温度区间B内的某温度时.两物质的溶解度会相等.
A.O℃-20℃B.20℃-40℃C.40℃-60℃D.60℃-80℃
(2)20℃时,称取31.6gKNO3固体加入盛有lOOg水的烧杯中,充分溶解形成的溶液是饱和(填“饱和”或“不饱和”)溶液.
(3)当KNO3中混有少量NaCl时,可以采用降温结晶的方法提纯KNO3,选用这种方法的理由是硝酸钾的溶解度受温度影响变化大.
(4)将60℃时的等质量的KNO3饱和溶液和NaCl溶液同时降溫到20℃.则下列对20℃时所得两种溶液的分析判断中,正确的是B(填序号)
A.溶剂质量:KNO3>NaCl
B.溶液质量:KNO3<NaCl
C.溶质质量分数:KNO3>NaCl.
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
A.O℃-20℃B.20℃-40℃C.40℃-60℃D.60℃-80℃
(2)20℃时,称取31.6gKNO3固体加入盛有lOOg水的烧杯中,充分溶解形成的溶液是饱和(填“饱和”或“不饱和”)溶液.
(3)当KNO3中混有少量NaCl时,可以采用降温结晶的方法提纯KNO3,选用这种方法的理由是硝酸钾的溶解度受温度影响变化大.
(4)将60℃时的等质量的KNO3饱和溶液和NaCl溶液同时降溫到20℃.则下列对20℃时所得两种溶液的分析判断中,正确的是B(填序号)
A.溶剂质量:KNO3>NaCl
B.溶液质量:KNO3<NaCl
C.溶质质量分数:KNO3>NaCl.
11.某人欲配置下列不同阴阳离子的四种溶液,其中能配成的是( )
| A. | Na+、OH-、K+、HPO42- | B. | Ca2+、K+、NO3-、Cl- | ||
| C. | Fe3+、Cl-、H+、I- | D. | Ca2+、Na+、CO32-、Cl- |
1.在强酸性溶液中,下列各组离子可能大量共存的是( )
| A. | Cu2+、NH4+、SO42-、Cl- | B. | Na+、K+、CO32-、Cl- | ||
| C. | K+、Fe2+、MnO4-、Cl- | D. | Na+、K+、F-、Cl- |
8.如图表示某化学反应的微观过程,下列有关说法正确的是( )


| A. | 该反应属于置换反应 | |
| B. | 生成物丙和丁的质量比为2:1 | |
| C. | 甲和乙的相对分子质量之和等于丙和丁的相对分子质量之和 | |
| D. | 该反应的化学方程式可表示为2C2H2+5O2$\frac{\underline{\;\;一定条件\;\;}}{\;}$4CO2+2H2O |

 如图是浓盐酸试剂瓶上标签的部分内容.请回答:
如图是浓盐酸试剂瓶上标签的部分内容.请回答: