题目内容
20.几位同学在实验室做木炭还原氧化铜的实验,实验完毕后,他们发现试管内仍有黑色固体物质存在.该试管中的黑色固体物质是什么?【提出猜想】
小玉同学:木炭. 小兰同学:氧化铜. 小华同学:木炭和氧化铜.
【查阅资料】
木炭、铜都不与稀硫酸反应;CuO能与稀硫酸(H2SO4)反应生成硫酸铜和水.
【实验设计】
方案一:向盛有黑色固体的试管中加入足量的稀硫酸,充分振荡,静置后观察现象.
方案二:取少量该黑色固体在空气中灼烧,观察现象.
他们对“方案一”进行了分析讨论,达成了共识:若试管内溶液无色、还有黑色固体存在,证明
小玉同学的猜想正确. 若试管中溶液呈蓝色、无黑色固体,证明小兰 同学的猜想正确.若出现的现象是试管中溶液呈蓝色、有黑色固体,证明小华同学的猜想是正确的,发生反应的化学方程式为CuO+H2SO4═CuSO4+H2O.
他们按照“方案二”进行了实验操作,记录如下:
| 实验现象 | 实验结论 |
| 黑色固体红热并逐渐减少,最后消失 | 该黑色固体是木炭. 反应的化学方程式是C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2 |
分析 木炭不能和稀硫酸反应,氧化铜和稀硫酸反应生成硫酸铜和水,硫酸铜溶液是蓝色的;加热时,氧化铜不能和空气中的氧气反应,木炭能和空气中的氧气反应生成二氧化碳.
解答 解:【方案一】
向盛有黑色固体的试管中加入足量的稀硫酸,充分振荡,静置后观察现象.若试管内溶液无色,还有黑色固体存在,说明固体中不含有氧化铜,证明小玉同学的猜想正确;
若试管中溶液呈蓝色、无黑色固体,说明固体中不含有木炭,证明小兰同学的猜想正确;
若出现的现象是试管中溶液呈蓝色、有黑色固体,证明小华同学的猜想是正确的,发生反应的化学方程式为:CuO+H2SO4═CuSO4+H2O.
故填:小玉;小兰;试管中溶液呈蓝色、有黑色固体;CuO+H2SO4═CuSO4+H2O.
【方案二】
取少量该黑色固体在空气中灼烧,黑色固体红热并逐渐减少,最后消失,说明固体中不含有氧化铜,只含有木炭,高温条件下木炭和氧气反应生成二氧化碳,反应的化学方程式为:C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2.
故填:木炭;C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
相关题目
9.科学探究是奇妙的过程,请你参与下面的实验探究.
【提出问题】在一个门窗紧闭刚上完课的教室内空气中的二氧化碳的含量,与教室外操场上空气中二氧化碳的含量有什么不同?
【提出猜想】小明认为:刚下课的教室内空气中二氧化碳的含量应该比室外操场上空气中二氧化碳的含量高.
【查阅资料】当空气中二氧化碳超过正常含量时,会对人体产生有害的影响.
【实验探究】用 排水集气法分别收集教室内和操场上气体各一瓶进行如下探究实验:
【拓展应用】(1)根据实验探究结果,你认为我们在教室里学习时应注意什么?开窗通风
(2)本实验中用排水法收集的方法在实验中具有应用价值,可用于我们收集实验室、仓库等位置的气体.如用此法收集仓库中的气体,你的实验操作是将集气瓶装满水,带进仓库内,将水倒出,盖上玻璃片.
【提出问题】在一个门窗紧闭刚上完课的教室内空气中的二氧化碳的含量,与教室外操场上空气中二氧化碳的含量有什么不同?
【提出猜想】小明认为:刚下课的教室内空气中二氧化碳的含量应该比室外操场上空气中二氧化碳的含量高.
【查阅资料】当空气中二氧化碳超过正常含量时,会对人体产生有害的影响.
【实验探究】用 排水集气法分别收集教室内和操场上气体各一瓶进行如下探究实验:
| 实验操作 | 实验现象 | 结论 |
| 将澄清的石灰水分别滴入盛有教室内的空气和操场上的空气的集气瓶中 | 教室内的空气瓶中石灰水变浑浊;操场上的空气瓶中石灰水无明显变化. | 教室内的空气中二氧化碳含量比操场上的空气中高. |
(2)本实验中用排水法收集的方法在实验中具有应用价值,可用于我们收集实验室、仓库等位置的气体.如用此法收集仓库中的气体,你的实验操作是将集气瓶装满水,带进仓库内,将水倒出,盖上玻璃片.
11.某研究性学习小组对“氯碱工业”生产的烧碱样品(可能含有碳酸钠、氯化钠等杂质)进行如下探究.
Ⅰ.定性探究
实验证明
Ⅱ.定量探究:
用下列装置测量烧碱样品中含碳酸钠的质量分数(提示:碱石灰成分为CaO和NaOH).请回答下列问题:
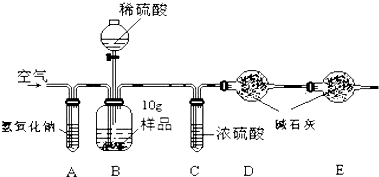
(1)装置A中氢氧化钠溶液的作用是除去空气中的二氧化碳气体;
(2)为什么先通一会儿空气后再进行装置B的化学反应,原因是将容器中的空气排干净,减小实验误差;
(3)写出装置B中化学反应产生气泡的化学方程式Na2CO3+H2SO4═Na2SO4+H2O+CO2↑,在滴加稀硫酸时,为什么要滴加到不再产生气泡为止保证将样品中的碳酸钠反应完,使测量结果更准确;
(4)本实验通过碱石灰增重测定CO2的质量,E装置的作用是吸收从装置右侧进入的空气的CO2.要称量的装置是D(填D或E或D、E).
Ⅰ.定性探究
实验证明
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁. | 试管外壁发热 | 原因是氢氧化钠溶于水放热 |
| ②向①所得的溶液中逐滴加入过量稀硝酸 | 一开始无明显现象,一段时间后产生能使澄清石灰水变浑浊的气体. | 样品中含有的 杂质是碳酸钠. |
| ③向②所得的溶液中滴加几滴硝酸银溶液 | 产生白色沉淀 | 样品中还含有的杂 质是氯化钠 |
用下列装置测量烧碱样品中含碳酸钠的质量分数(提示:碱石灰成分为CaO和NaOH).请回答下列问题:

(1)装置A中氢氧化钠溶液的作用是除去空气中的二氧化碳气体;
(2)为什么先通一会儿空气后再进行装置B的化学反应,原因是将容器中的空气排干净,减小实验误差;
(3)写出装置B中化学反应产生气泡的化学方程式Na2CO3+H2SO4═Na2SO4+H2O+CO2↑,在滴加稀硫酸时,为什么要滴加到不再产生气泡为止保证将样品中的碳酸钠反应完,使测量结果更准确;
(4)本实验通过碱石灰增重测定CO2的质量,E装置的作用是吸收从装置右侧进入的空气的CO2.要称量的装置是D(填D或E或D、E).
9.如图实验基本操作中,正确的是( )
| A. |  送入药品 | B. |  存放氢气 | C. |  溶解固体 | D. |  稀释浓硫酸 |
10. 某同学设计了以下三个实验(如图所示)证明金属的活动性强弱.要排列出Cu、Zn、Ag的活动性顺序,必须要做的实验是( )
某同学设计了以下三个实验(如图所示)证明金属的活动性强弱.要排列出Cu、Zn、Ag的活动性顺序,必须要做的实验是( )
 某同学设计了以下三个实验(如图所示)证明金属的活动性强弱.要排列出Cu、Zn、Ag的活动性顺序,必须要做的实验是( )
某同学设计了以下三个实验(如图所示)证明金属的活动性强弱.要排列出Cu、Zn、Ag的活动性顺序,必须要做的实验是( )| A. | ②③ | B. | ①③ | C. | ①② | D. | ①②③ |

