题目内容
10.合理使用资源,对环境保护起着重要作用.(1)为了减轻对环境的污染,人类正在开发潮汐能、核能、生物质能、太阳能(或地热能、风能等)等新能源.
(2)垃圾的回收利用和处理有利于节约资源和减轻环境的污染.下列属于可回收垃圾的是①②(填序号).
①易拉罐 ②废报纸 ③剩菜、果皮.
分析 (1)根据能源的种类进行分析,新能源是指无污染、可以持续利用的能源,包括太阳能、风能、核能、地热能、潮汐能等.
(2)可回收垃圾是可以再生循环的垃圾,是指纸类、塑料、橡胶、金属、玻璃等回收后具有利用价值的垃圾,据此进行分析解答.
解答 解:(1)为了减轻对环境的污染,人类正在开发潮汐能、核能、生物质能、太阳能、地热能、风能等新能源.
(2)可回收垃圾是可以再生循环的垃圾,主要包括废纸、塑料、玻璃、金属和布料五大类;①易拉罐、②废报纸属于可回收垃圾;③剩菜、果皮属于不可回收垃圾,属于不可回收垃圾中的厨余垃圾.
故答案为:(1)太阳能(或地热能、风能等);(2)①②.
点评 本题难度不大,了解常见的新能源范畴与种类、可回收垃圾的概念与范畴等是正确解答本题的关键.

练习册系列答案
相关题目
20.下列物质相互混合,能发生反应的是( )
| A. | 硫酸钠和碳酸钠 | B. | 氢氧化钠和硝酸钠 | ||
| C. | 稀硝酸和硫酸钡 | D. | 氧化镁和稀硫酸 |
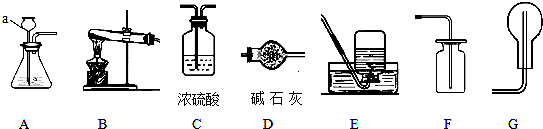
5.下列实验操作中,不正确的是( )
| A. |  滴加液体药品 | B. |  蒸发食盐水 | C. |  称量固体 | D. |  倾倒液体 |
2.城市污水井、排污管道经常发生中毒事故或因燃放炮竹引发的爆炸事故.某小组同学在专业人员帮助下收集气体样品对其成分进行探究.
【查阅资料】
I 城市污水井、排污管道中的有机物质发酵会产生CO、CO2、H2S、CH4等气体.
Ⅱ硫化氢(H2S)有剧毒,溶于水形成氢硫酸,实验室中除去H2S的方法是将其通入硫酸铜溶液中,形成黑色的硫化铜,化学方程式为CuSO4+H2S═CuS↓+H2SO4.
Ⅲ等体积均为10%的邻苯三酚溶液与氢氧化钠溶液混合时可以快速除去氧气,且溶液颜色逐渐变深.
【进行实验】小组同学设计了下图所示的装置并进行探究.

通入气体样品前先通入N2排出各装置中的空气.
实验现象记录与分析:
【实验反思】
(1)该实验中无法确定的气体是CO,确定是否含有该气体中的方法是:收集燃烧产物,将燃烧产物依次通过盛有浓硫酸和氢氧化钠溶液的装置,分别称量吸收燃烧产物前、吸收燃烧产物后装置的质量,通过计算、分析得出结论.
(2)实验中若检验H2S后就检验氧气,是否能得到实验结论、理由是不能,因为除去氧气的药品中含有NaOH,除去氧气的同时也将CO2除去了.
【查阅资料】
I 城市污水井、排污管道中的有机物质发酵会产生CO、CO2、H2S、CH4等气体.
Ⅱ硫化氢(H2S)有剧毒,溶于水形成氢硫酸,实验室中除去H2S的方法是将其通入硫酸铜溶液中,形成黑色的硫化铜,化学方程式为CuSO4+H2S═CuS↓+H2SO4.
Ⅲ等体积均为10%的邻苯三酚溶液与氢氧化钠溶液混合时可以快速除去氧气,且溶液颜色逐渐变深.
【进行实验】小组同学设计了下图所示的装置并进行探究.

通入气体样品前先通入N2排出各装置中的空气.
实验现象记录与分析:
| 实验现象 | 结论与化学方程式 |
| A中出现黑色固体;B中澄清石灰水变浑浊;D中溶液逐渐变为墨绿色;F中烧杯内壁出现无色液滴. | B中发生反应的化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O;装置E中药品的作用是除去气体中混有的水蒸气;收集的气体样品中一定含有H2S、CO2、CH4、O2. |
(1)该实验中无法确定的气体是CO,确定是否含有该气体中的方法是:收集燃烧产物,将燃烧产物依次通过盛有浓硫酸和氢氧化钠溶液的装置,分别称量吸收燃烧产物前、吸收燃烧产物后装置的质量,通过计算、分析得出结论.
(2)实验中若检验H2S后就检验氧气,是否能得到实验结论、理由是不能,因为除去氧气的药品中含有NaOH,除去氧气的同时也将CO2除去了.
19.兴趣小组同学在实验室处理废液时,将一瓶已有结块的熟石灰取样,加入含有盐酸的废液中,发现废液中产生大量的气泡.他们进一步了解熟石灰样品变质的程度进行以下探究活动.
【探究活动一】检测熟石灰样品是否完全变质
【探究活动二】测定变质的熟石灰样品中碳酸钙的质量分数利用如图所示装置和试剂进行实验(铁架台略去,装置气密性良好,忽略盐酸的挥发性且每步反应或作用都是完全的),称取5g的样品,通过测定样品和稀盐酸
反应产生的气体的质量,计算碳酸钙的质量分数.
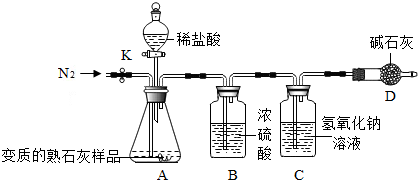
【实验步骤】
①按图连接装置,并检查装置的气密性;
②如图连接装置(除C、D外)并加入5.00g的样品(称量时使用电子天平);
③称量并记录装置C的总质量为200.00g(称量时注意封闭C的两端);
④打开弹簧夹K,鼓入N2约1分钟;
⑤接入装置C、D,关闭弹簧夹K,装置A中加入稀盐酸,至不再产生气泡为止;
⑥重复步骤④操作,称量,装置C的质量为200.88g(称量时注意封闭C的两端);
⑦计算.
回答下列相关问题:
(1)写出A中产生气体的反应化学方程式CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)装置B中浓硫酸的作用是吸收水分;已知碱石灰的主要成分是CaO和NaOH,则装置D的作用是防止空气中的CO2进入C装置中.
(3)步骤⑤中加入稀盐酸,至不再产生气泡为止,其目的是使得CaCO3完全反应;
(4)步骤⑥中装置C的质量不再增加,说明CO2被NaOH完全吸收,写出装置C中反应的化学方程式:CO2+2NaOH═Na2CO3+H2O.
(5)依题意可得CO2气体的质量为0.88gg,样品中碳酸钙的质量为2gg.测定变质的熟石灰样品中碳酸钙的质量分数=40%.
(6)下列操作会导致测量结果偏低的是D(填序号).
A.省略装置B B.没有进行步骤④的操作C.鼓入N2时间较长 D.步骤⑥没有重复步骤④的操作.
【探究活动一】检测熟石灰样品是否完全变质
| 实验操作 | 实验现象 | 实验结论 |
| 取样于试管中,加水溶解,往上层溶液中滴加无色酚酞 | 溶液显红色 | 变质的熟石灰中仍含氢氧化钙 |
反应产生的气体的质量,计算碳酸钙的质量分数.

【实验步骤】
①按图连接装置,并检查装置的气密性;
②如图连接装置(除C、D外)并加入5.00g的样品(称量时使用电子天平);
③称量并记录装置C的总质量为200.00g(称量时注意封闭C的两端);
④打开弹簧夹K,鼓入N2约1分钟;
⑤接入装置C、D,关闭弹簧夹K,装置A中加入稀盐酸,至不再产生气泡为止;
⑥重复步骤④操作,称量,装置C的质量为200.88g(称量时注意封闭C的两端);
⑦计算.
回答下列相关问题:
(1)写出A中产生气体的反应化学方程式CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)装置B中浓硫酸的作用是吸收水分;已知碱石灰的主要成分是CaO和NaOH,则装置D的作用是防止空气中的CO2进入C装置中.
(3)步骤⑤中加入稀盐酸,至不再产生气泡为止,其目的是使得CaCO3完全反应;
(4)步骤⑥中装置C的质量不再增加,说明CO2被NaOH完全吸收,写出装置C中反应的化学方程式:CO2+2NaOH═Na2CO3+H2O.
(5)依题意可得CO2气体的质量为0.88gg,样品中碳酸钙的质量为2gg.测定变质的熟石灰样品中碳酸钙的质量分数=40%.
(6)下列操作会导致测量结果偏低的是D(填序号).
A.省略装置B B.没有进行步骤④的操作C.鼓入N2时间较长 D.步骤⑥没有重复步骤④的操作.