题目内容
2.钢铁是使用最多的金属材料.(1)人类向大自然提取量最大的金属是铁,写出高温下一氧化碳把铁从赤铁矿石中还原出来的化学方程式Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(2)锰(Mn)钢属于铁合金,可用于制造钢轨.取少量锰钢碎屑加入盛有足量稀盐酸的烧杯中,浸泡以后烧杯底部剩有固体,该固体中一定含有C(或碳).已知锰的金属活动性强于锌,如果用实验比较铁和锰的金属活动性强弱,下列所给试剂组能够达到目的是AC(填序号).
A.Fe、Mn、40%H2SO4溶液 B.Fe、Mn、MgSO4溶液
C.Fe、Mn、ZnSO4溶液 D.Cu、FeSO4溶液、MnSO4溶液.
分析 (1)赤铁矿的主要成分是氧化铁,在高温的条件下能被一氧化碳还原;
(2)根据铁合金中含有少量的碳以及验证金属活动性的方法来分析解答.
解答 解:(1)在高温的条件下,一氧化碳与氧化铁反应生成铁和二氧化碳,其化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(2)根据题干信息,锰的活动性大于锌,因为已知锌的活动性大于铁,那么取质量相同、颗粒大小相同的Fe、Mn加入足量的40%H2SO4溶液中,放出气体速率快的为锰,也可选择C来验证铁和锰的活动性:铁不能置换出硫酸锌中的锌,说明铁不如锌活泼,锰能置换出硫酸锌中的锌,说明锰比铁活泼,BD选项中不会有明显现象发生,故选AC.
故答案为:(1)Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;(2)C(或碳);AC.
点评 本题难度不是很大,主要考查铁的冶炼以及对金属活动性顺序的应用,从而培养学生对知识的灵活运用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.某化学兴趣小组取用2.0g石灰石样品,把25.0g质量分数为10%的稀盐酸分五次加入样品中(样品中的杂质既不与盐酸反应,也不溶解于水),每次充分反应后都经过滤、干燥、称量,得实验数据如表:
请计算:
(1)2.0g石灰石样品中碳酸钙的质量为1.7g,石灰石中碳酸钙的质量分数为85%.
(2)请你继续计算反应生成溶液中溶质的质量分数(计算过程和结果均保留一位小数).
| 实验次数 | 1 | 2 | 3 | 4 | 5 |
| 稀盐酸的累计加入量 | 5.0g | 10.0g | 15.0g | 20.0g | 25.0g |
| 剩余固体的质量 | 1.5g | 1.0g | 0.5g | 0.3g | 0.3g |
(1)2.0g石灰石样品中碳酸钙的质量为1.7g,石灰石中碳酸钙的质量分数为85%.
(2)请你继续计算反应生成溶液中溶质的质量分数(计算过程和结果均保留一位小数).
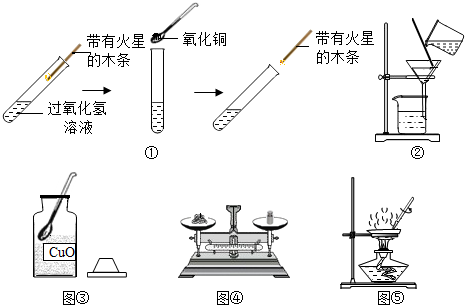
7.学习了MnO2对过氧化氢分解有催化作用的知识后,小芳同学想:CuO能否起到类似MnO2的催化剂作用呢?于是进行了以下探究.
【实验】用天平称量0.2gCuO,取5mL5%的过氧化氢溶液于试管中,进行如图实验:

(1)填写如表:
(2)步骤①的目的是证明不加氧化铜过氧化氢能产生氧气但是速率慢.
(3)步骤④需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯、玻璃棒.
(4)过氧化氢能被CuO催化分解放出O2的化学方程式为2H2O2$\frac{\underline{\;CuO\;}}{\;}$2H2O+O2↑.
(5)请你帮助小芳同学设计实验证明步骤⑤所得固体确实已经烘干,你的方案为:在固体上加无水硫酸铜,固体不变蓝,说明已经烘干.
【实验】用天平称量0.2gCuO,取5mL5%的过氧化氢溶液于试管中,进行如图实验:

(1)填写如表:
| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
| 溶液中产生气泡较快 带火星的木条复燃. | 固体质量不变 | 溶液中有气泡放出, 带火星的木条复燃 | 猜想成立. |
(3)步骤④需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯、玻璃棒.
(4)过氧化氢能被CuO催化分解放出O2的化学方程式为2H2O2$\frac{\underline{\;CuO\;}}{\;}$2H2O+O2↑.
(5)请你帮助小芳同学设计实验证明步骤⑤所得固体确实已经烘干,你的方案为:在固体上加无水硫酸铜,固体不变蓝,说明已经烘干.
12.下列说法正确的是( )
| A. | 将烧红的铁丝伸入盛有空气的集气瓶中剧烈燃烧 | |
| B. | 含氧元素的物质不一定是氧化物,氧化物一定含有氧元素 | |
| C. | 将pH试纸润湿后放在玻璃片上.用玻璃棒蘸取待测液滴在pH试纸上 | |
| D. | 用嘴吹灭蜡烛主要是因为呼出气体中含有CO2 |